全国服务热线400-151-5198 业务咨询15800353038
脑科学研究的关键是要实现对神经元集群活动的实时观察,并通过特定神经环路的结构追踪及其活动操纵,研究其对脑功能的充分性和必要性,进而在全脑尺度上解析神经环路的功能和结构。
钙离子成像技术
钙离子成像技术(Calcium imaging)是指利用钙离子指示剂监测组织内钙离子浓度的方法,常用于神经系统的研究,指示神经元内钙离子的变化,提示神经元活动。其原理在于借助钙离子浓度与神经元活动之间的严格对应关系,利用特殊的荧光染料或者蛋白质荧光探针(钙离子指示剂,Calcium indicator),将神经元中钙离子的浓度通过荧光强度表现出来,并被显微镜捕捉,从而达到监测神经元活动的目的。
因而,钙离子成像技术的核心在于钙离子指示剂,现在广泛使用的钙离子指示剂有化学性钙离子指示剂(chemical indicators)和基因编码钙离子指示剂(genetically-encoded indicators)两类:
1、化学性钙离子指示剂:指的是可以螯合钙离子的小分子,所有这些小分子都基于BAPTA(氨基苯乙烷四乙酸),BAPTA能够特异性地和钙离子螯合,而不会和镁离子螯合,所以被广泛地用作钙离子螯合剂。目前较为成熟的化学性钙离子指示剂包括Oregon Green-1、Fura-2、Indo-1、Fluo-3、Fluo-4。
2、基因编码钙离子指示剂:这些指示剂是来自于绿色荧光蛋白(GFP)及其变异体(例如循环排列GFP、YFP、CFP)的荧光蛋白质,与钙调蛋白(CaM)和肌球蛋白轻链激酶M13域融合。现在使用较广泛的基因编码钙离子指示剂有:GCaMP、Pericams、Cameleons、TN-XXL和Twitch,其中GCaMP6由于它有着超强的敏感度,现在被广泛应用于活体钙成像研究,其发出荧光的原理在于钙离子浓度上升导致M13与CaM结合,从而改变cpEGFP的构象,将其从无荧光的状态变为绿色荧光。
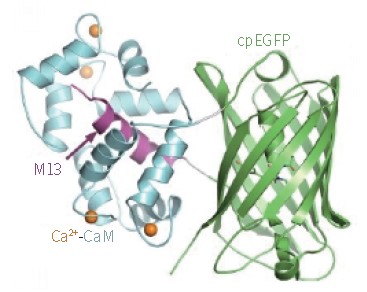
GCaMP蛋白的基本结构和原理(Jasper Akerboom, et al., Biol Chem,2009)
常见的可遗传编码钙离子指示剂
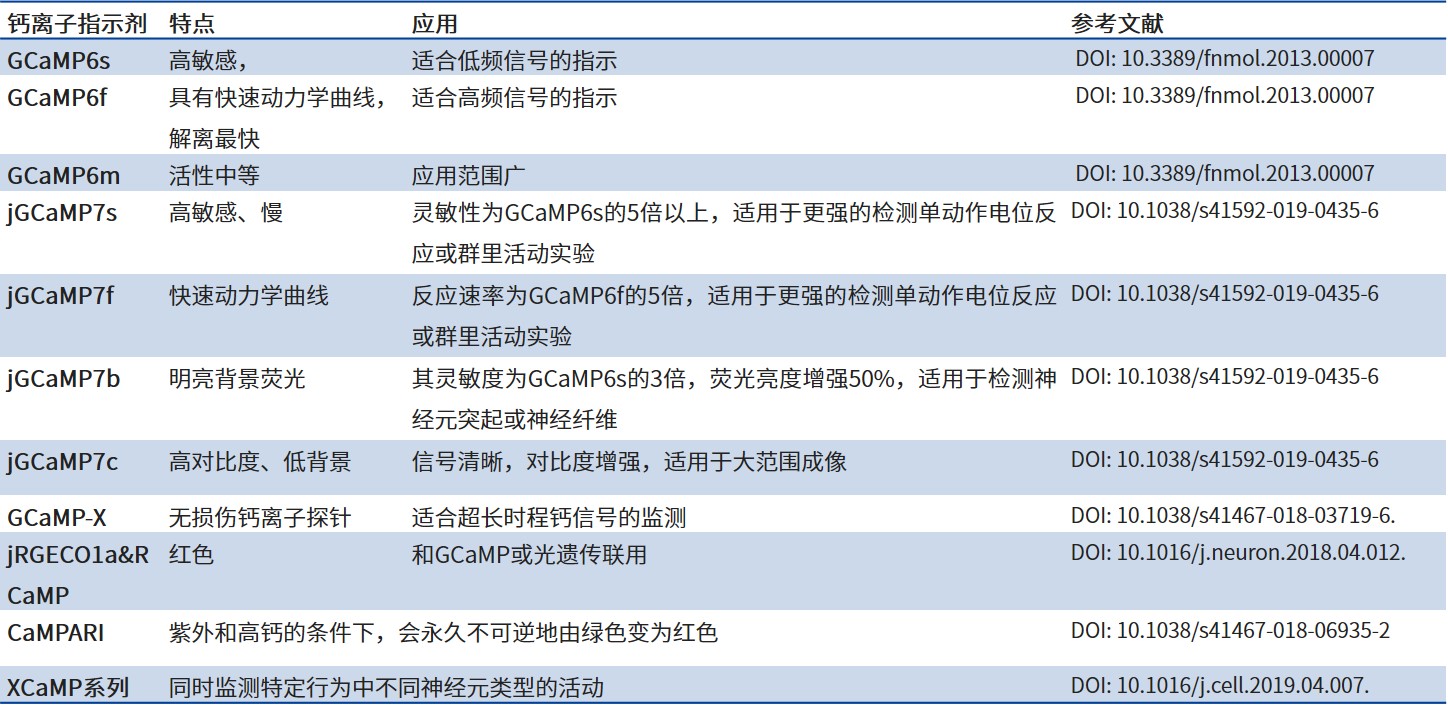
钙离子成像技术是一类可以在活体动物观察神经元活动的技术,其突出优点在于能够同时观察一群细胞的活动,借助病毒载体的特异性表达能力和神经环路标记能力,我们还可以观察特定类型细胞的活动。
电压成像技术
神经元细胞膜上的电势是大脑中重要的信息载体。因此,监测单个神经元的电压动态,从突触输入到轴突输出,对于理解行为背后的神经过程是至关重要的。
细胞的细胞膜上镶嵌的各种转运蛋白和跨膜离子通道可以控制Na+、K+等离子进出细胞。从而形成持续存在的跨膜离子浓度梯度,由此形成的胞内外的电位差异就是膜电位。当细胞接受外界刺激时,膜电位会发生变化,而电压成像技术的基本原理就在于通过对电压敏感的荧光指示剂 (Voltage Indicators) 直接标记膜电位变化,再借助荧光成像手段监测神经元电活动。
1、最初科学家们会借助传统电压敏感染料进行神经活动的动态研究,然而电压敏感染料的光信号太弱,由膜电位变化引起的染料信号变化只有静息时背景光强的万分之一到百分之一,同时,化学染料对细胞选择性差,无法做到特异性对不同类型的细胞进行观察。此外,电压敏感染料会导致细胞发生永久性的变化,甚至改变其光动力学性质,无法对活体动物进行长期观察。
2、基因编码的电压指示剂(genetically encoded voltage indicators, GEVIs):和电压敏感染料相比,GEVIs 最大的优势就是可以特异性地标记各种类型的神经元或亚细胞结构,实现高时空分辨率的成像工作。GEVIs 一般基于以下三种工作机制:
①膜电位发生变化时,细胞膜上镶嵌的许多蛋白质分子都会改变形状,这类随膜电位改变形状的蛋白分子叫电压敏感元件。将电压敏感元件与荧光蛋白或化学共价荧光标记蛋白相结合,形成一个嵌和蛋白,当细胞膜电压发生改变时,电压蛋白构象发生变化会干扰荧光蛋白发色团的化学环境,从而改变荧光亮度。
②基于视紫红质等视蛋白(Opsin)的电压敏感荧光探针,微生物视紫红质的吸收和荧光都是电压敏感的,且反应迅速,膜电位发生变化时,视蛋白通道构象发生改变,进而影响视蛋白的荧光发生变化。
③能够感知电压变化的FRET(荧光能量共振转移, fluorescence resonance energy transfer, FRET)探针,将荧光蛋白融合到电压敏感元件或视蛋白上,当细胞膜电位发生变化时,带电荷的有机分子会在细胞膜中移动,从而导致相连的荧光蛋白产生荧光共振能量转移效应,改变其荧光亮度。
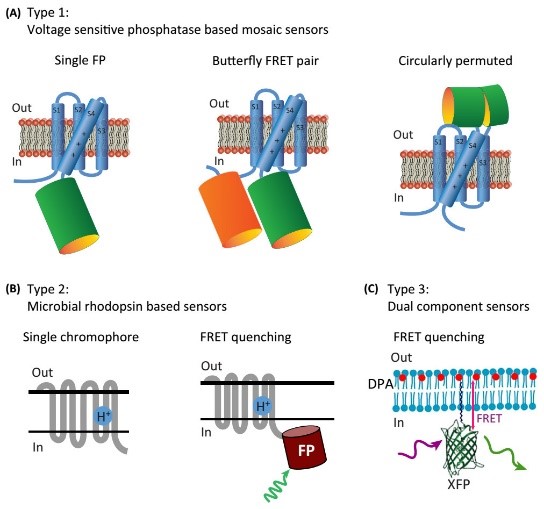
三种类型GEVIs的示意图
(Storace, D., et al., Trends Neurosci, 2016)
电压成像病毒列表

神经元功能成像是探究神经元编码各种功能的重要科学手段,目前最常用方法为钙成像和电压成像。然而,神经元钙信号衰减很慢,不能充分表征动作电位与阈下电位。基因编码的电压指示剂(GEVIs)能够以高空间和时间分辨率监测神经元的快速放电信号与阈下电活动,实时监测细胞膜电位的波动,相比于钙指标,更能直接反映神经元的活性。
神经递质探针
人脑大约有10
10-10
12个神经元,每个神经元拥有10
3-10
4个突触与其他神经元形成联系。神经递质作为突触间传递信息的重要“信使”,参与多种生理过程。神经递质的正常释放对于维持机体正常的生理功能发挥着重要作用,同时,神经递质的释放与调节出现异常时,也常常伴随着神经退行性疾病、抑郁症等疾病的发生发展。因此,在分子、细胞、环路等层面精确地分析检测神经递质是如何参与并调节上述生理和病理过程,能够更深入地了解疾病的发病机制,并为临床药物的开发奠定基础。
要更好地研究这些神经递质在生理、病理过程中扮演的角色,研究人员需要实时检测活体内特定脑区的神经递质信号变化,看清它们的“一举一动”。可遗传编码的神经递质探针的成功开发可以实时精确的检测内源神经递质的动态变化,为研究大脑的复杂功能以及神经系统疾病机制的解析提供重要的工具。
由于该类探针具有可基因编码的特性,研究者可以通过转染、病毒注射以及构建转基因动物等手段,将新型探针表达在细胞、小鼠脑片,以及活体果蝇、斑马鱼及小鼠中,并结合现有的成像技术,把“难以捉摸”的神经递质变化情况变成了直观、易测的荧光信号,做到在不影响细胞正常生理功能的情况下实时精确的检测活体动物中内源神经递质的动态变化。在此基础上,科学家们还对探针进行了全方位的优化,,使具有极高的分子特异性和时空分辨率(时间上达到毫秒级,空间上即可测得特定脑区的整体观,也可精确至单细胞)。
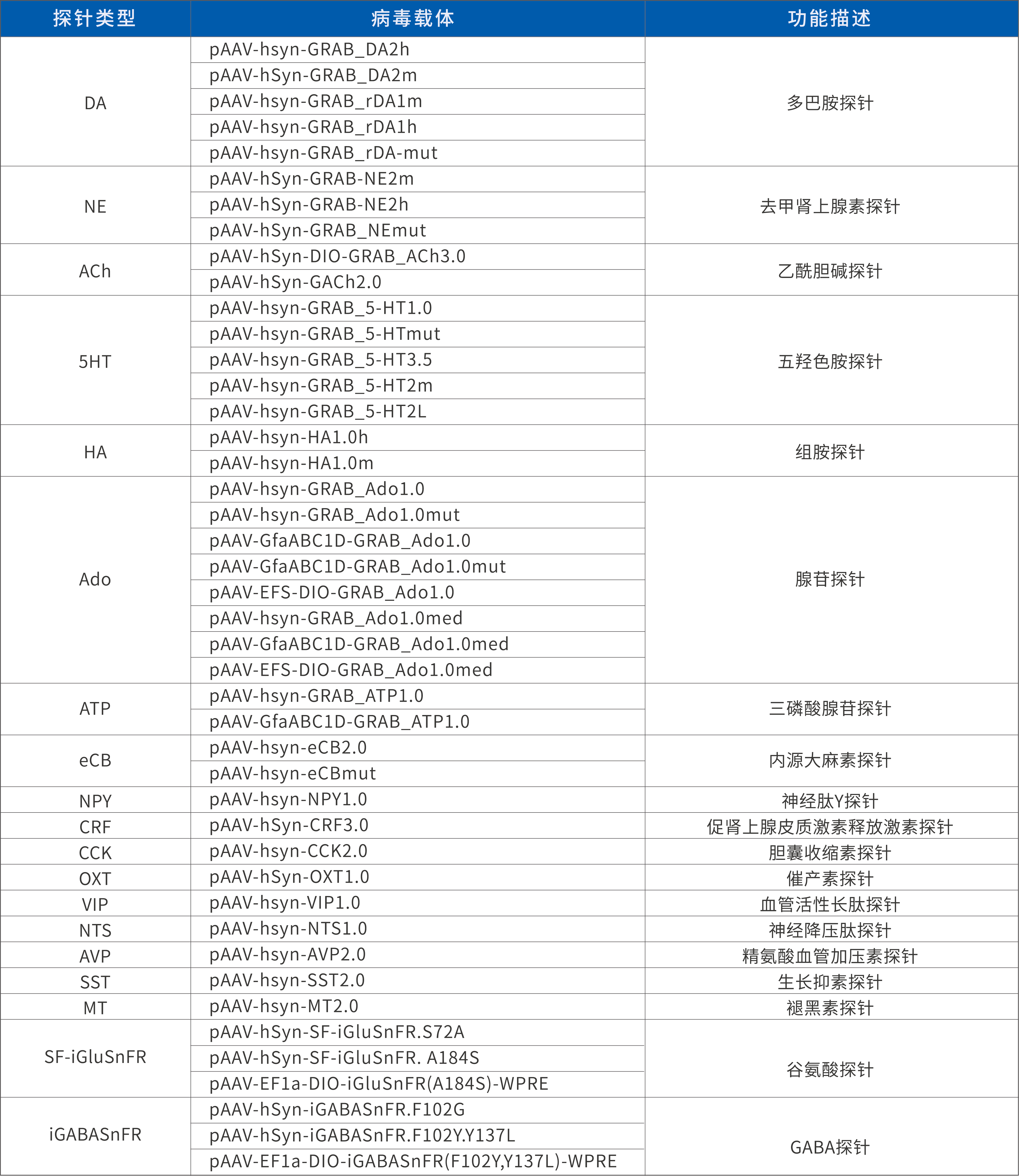
常见的可遗传编码的神经递质探针
①GRAB神经递质荧光探针:
北京大学李毓龙教授团队利用可与神经递质相结合的G蛋白偶联受体(GPCR)作为探针的骨架,成功开发出一系列新型可遗传编码的神经递质荧光探针。其原理在于:在 GPCR 中存在一段配体(神经递质)结合后构象改变最显著的区域,将循环重排并对构象变化敏感的绿色荧光蛋白(cpEGFP)插入到该区域中,神经递质与GPCR的结合会引起其构象的改变,而这种变化又引起cpEGFP发生构象的变化,进一步影响其发色团周围的微环境,最终导致其荧光强度的改变。
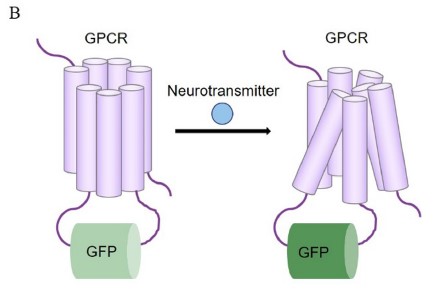
GRAB神经递质荧光探针示意图
(Li Research Lab http://www.yulonglilab.org/resources_cn.html)
②基于单荧光蛋白的可遗传编码的荧光探针:融合了来自细菌中可与神经递质结合的蛋白以及经过循环重排并对构象变化敏感的绿色荧光蛋白(cpEGFP),当神经递质与探针结合后,由于构象改变而引发cpEGFP 荧光强度的变化,检测神经递质的释放。

iGluSnFR结构示意图
(Marvin JS, et al., Nat Methods. 2013)
神经递质探针病毒载体列表
1、GCaMP6f
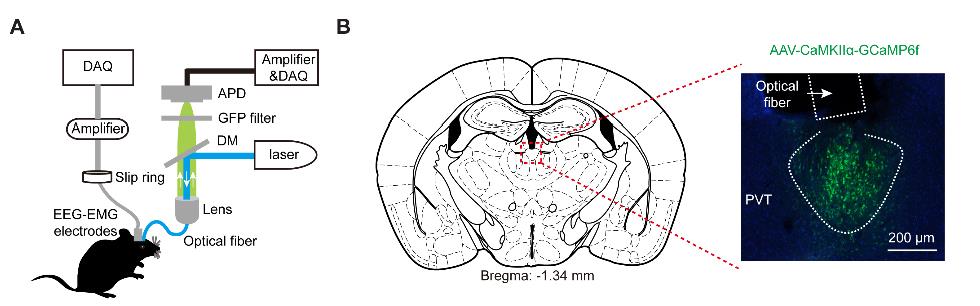
客户发表文章:Science. (IF=41.058). Ren S,et.al. (2018). The paraventricular thalamus is a critical thalamic area for wakefulness. [腺相关病毒, 觉醒]
注射部位:小鼠PVT
载体:AAV-CaMKIIα-GCaMP6f
注射体积:100nl
观察时间:4周
2、GCaMP6s
①客户发表文章:Science. (IF=41.058). Mu D,et.al. (2017). A central neural circuit for itch sensation. [腺相关病毒, 痒, 光遗传, 化学遗传,钙成像]
注射部位:小鼠PBN
载体:AAV-hSyn-GCaMP6s
血清型:rAAV2/9
病毒滴度:5.3E+12VG/mL
注射体积:300nl
观察时间:3周
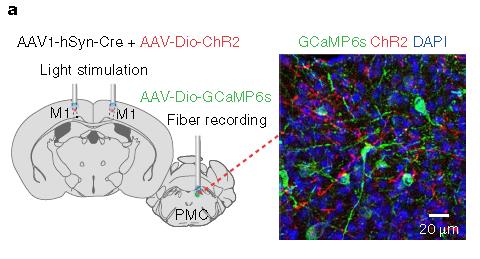
②客户发表文章:Nature Neuroscience. (IF=19.912). Yao J,et.al. (2018). A corticopontine circuit for initiation of urination. [腺相关病毒, 神经环路]
注射部位:小鼠皮层M1、PMC
载体:rAAV2/1-hSyn-Cre&rAAV2/9-DIO-hChR2(H134R)-mCherry、rAAV2/9-DIO-GCaMP6s
病毒滴度:rAAV2/1: 5E+12 VG/mL;rAAV2/9-DIO-hChR2:1.2E+13VG/mL;rAAV2/9-DIO-GCaMP6s:0.5E+12 VG/mL
注射体积:多点注射,每位点30-40nl
观察时间:4周
3、GCaMP5G
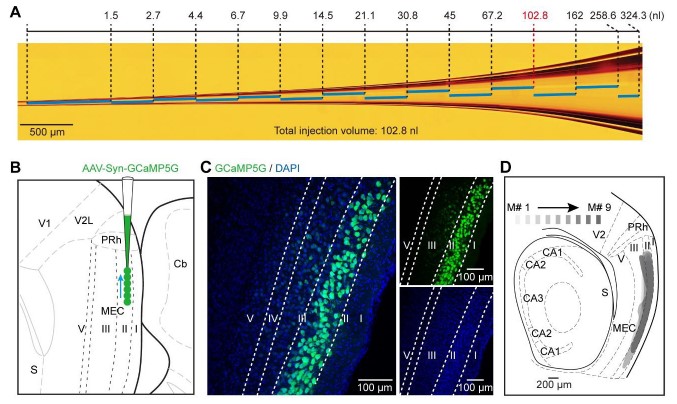
客户发表文章:Neuron. (IF=14.319). Han Q,et.al. (2018). A Visual-Cue-Dependent Memory Circuit for Place Navigation. [AAV, 学习与记忆, 钙成像]
注射部位:小鼠MECII
载体:pAAV-Syn-GCaMP5G
血清型:rAAV2/9
注射体积:约100nl
观察时间:4周
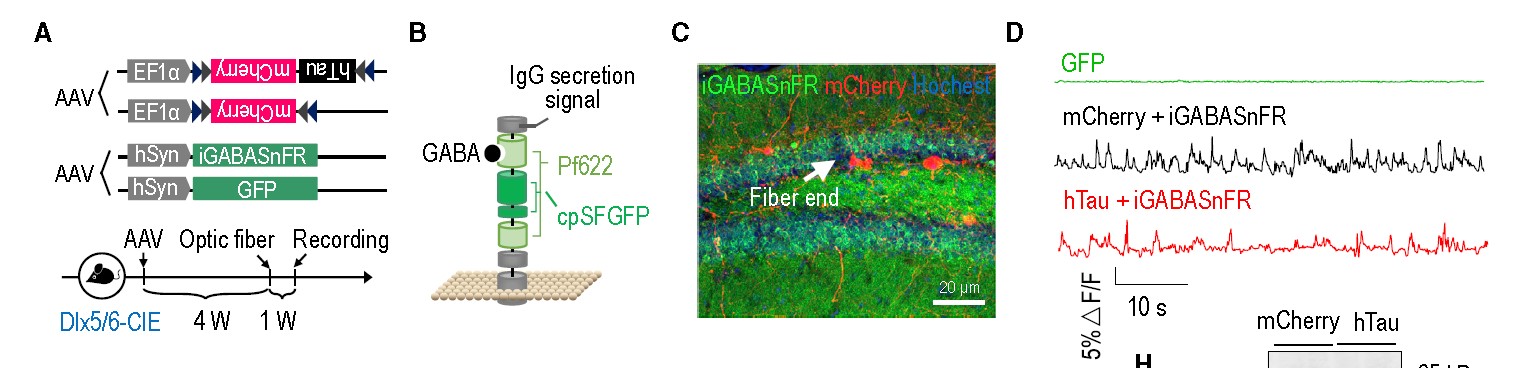
4、iGABASnFR探针
客户发表文章:Cell stem cell. (IF=20.86). Zheng J,et.al. (2018). Interneuron Accumulation of Phosphorylated tau Impairs Adult Hippocampal Neurogenesis by Suppressing GABAergic Transmission. [AAV, AD, 神经递质探针]