
【Nature Neuroscience】抑癌基因体内功能筛选新办法:AAV CRISPR突变库!
胶质母细胞瘤(Glioblastoma multiforme)是脑癌中死亡率最高和最常见的一种,是除脑干胶质瘤外预后情况最不乐观的中枢神经系统癌症。
雪上加霜的是,目前的所有治疗手段都无法治愈胶质母细胞瘤患者,患者的中位生存期仅有12.2-18.2个月。因此,全世界的科学家、医生都在努力检测和治疗这种恶性疾病。
在基因检测层面,人们对胶质母细胞瘤患者进行的基因图谱分析发现了223个基因中的453个突变位点,并最终找出71个显著突变基因(SMGs)。然而,大量新发现的基因功能从未被解读,特别是这些基因在胶质母细胞瘤中的作用尚不清楚。
而由于不同患者个体中的基因突变组合不同,我们难以解释复杂的突变与疾病的因果关系,也造成胶质母细胞瘤患者病程的差异化及抗药性的不同。
因此,我们需要对胶质母细胞瘤进行深入的基因功能分析和表型定量测定,这对于治疗该疾病至关重要。但是,目前没有任何一项研究能够给出结论,说明在患者中发现的某些突变基因能够驱动正常细胞转化为胶质母细胞瘤。
本周一,来自耶鲁大学医学院的华人科学家Sidi Chen与瑞士巴塞尔的Randall J Platt教授,以及CRISPR领域大牛张锋教授合作,在Nature Neuroscience发表了最新工作[1]。他们借助AAV病毒载体介导的在体CRISPR扫描技术,在完全免疫活性的小鼠脑中,利用获取测序手段读取突变数据和转录组分析等多技术,成功地筛选了一系列导致脑胶质母细胞瘤发生的关键基因突变。
和元上海一直关注肿瘤研究领域的重大研究进展,为科研工作者提供优质的病毒工具和整体解决方案,助力临床转化和基因治疗!1. 脑定位注射AAV-CRISPR库诱导胶质母细胞瘤的产生
为了在小鼠脑中直接检测胶质母细胞瘤相关的显著突变基因功能,作者开发了一套基于AAV载体和CRISPR技术的在体扫描策略,直接在小鼠脑原位构建胶质母细胞瘤模型(图1)。
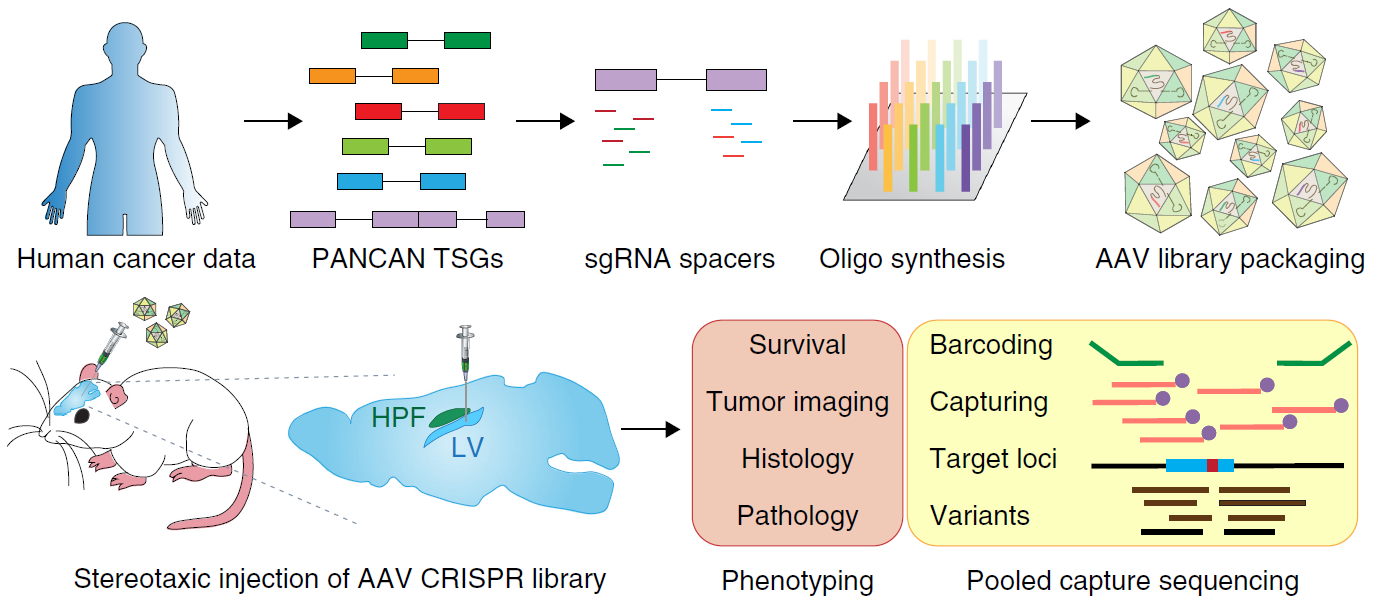
通过将抑癌基因(mTSG)库(该库包含针对Trp53的sgRNA,用于促进小鼠组织的肿瘤发生,亦包含其他的显著突变基因靶点sgRNA)注射到脑中,配合MRI扫描,作者发现注射mTSG库的动物明显出现了肿瘤,且动物的生存周期亦明显降低(图2)。这说明AAV-CRISPR策略能够在小鼠体内诱导肿瘤的产生。
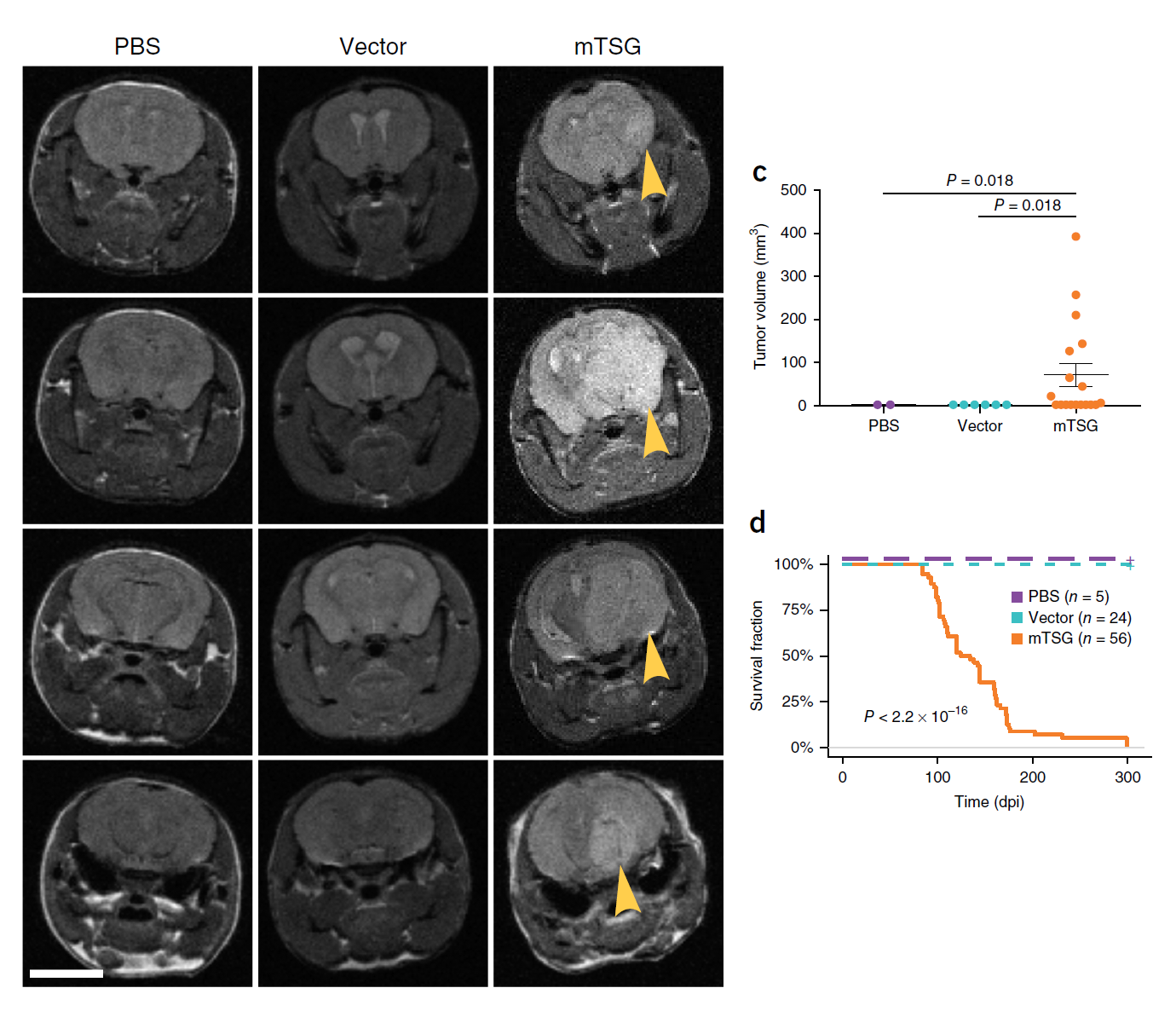 图2 注射mTSG突变库的小鼠脑中
明显出现了肿瘤
2. AAV-mTSG注射的小鼠脑肿瘤展现了胶质母细胞瘤的特点
图2 注射mTSG突变库的小鼠脑中
明显出现了肿瘤
2. AAV-mTSG注射的小鼠脑肿瘤展现了胶质母细胞瘤的特点
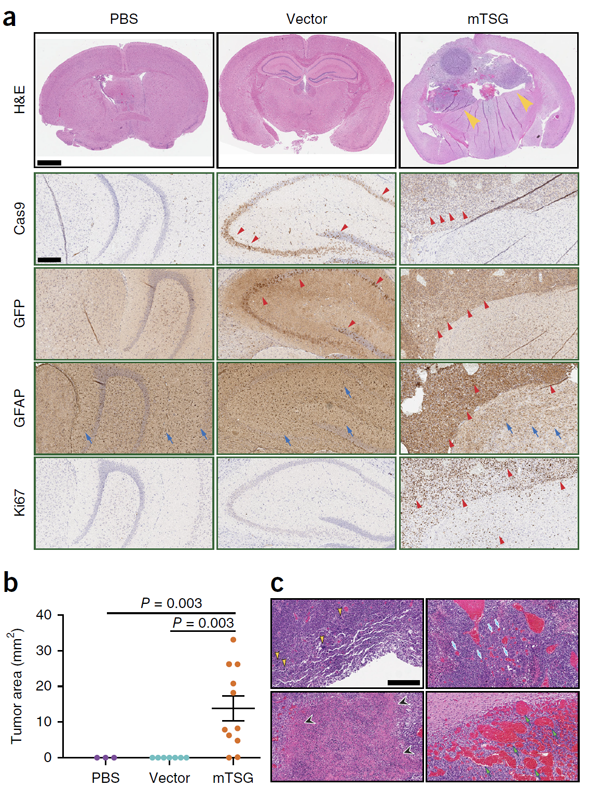
通过免疫组化实验,作者发现AAV-mTSG注射的小鼠所产生的肿瘤非常明显,其特征与人类胶质母细胞瘤患者的肿瘤特征非常像,提示AAV-mTSG成功诱导了胶质母细胞瘤模型(图3)。
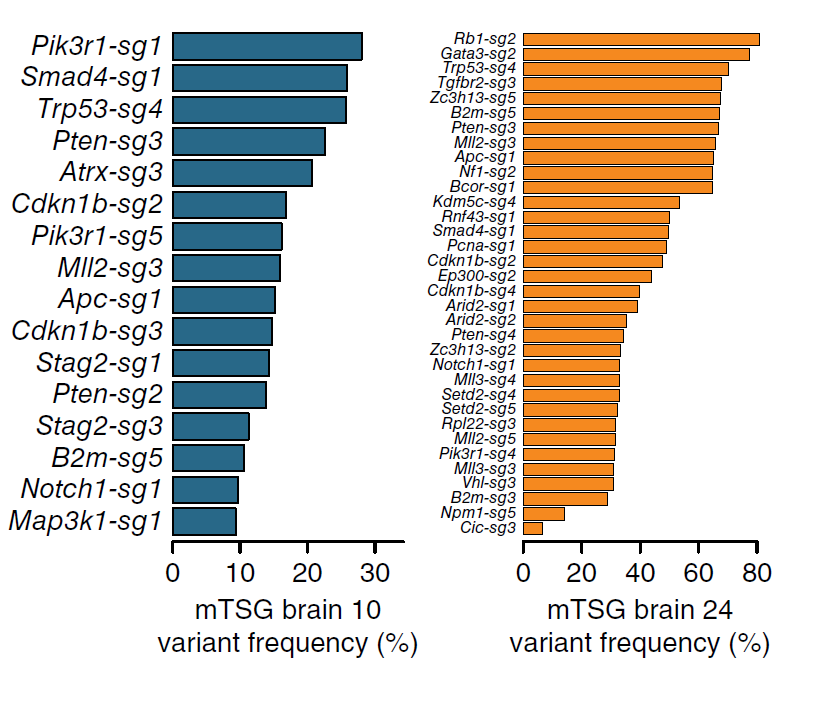
构建模型的目的在于找到肿瘤发生的关键分子靶点,为了达到此目的,作者应用靶向获取测序(Targeted-capture sequencing)的手段,在AAV-mTSG鼠的脑中筛选到了若干突变基因(图4)。
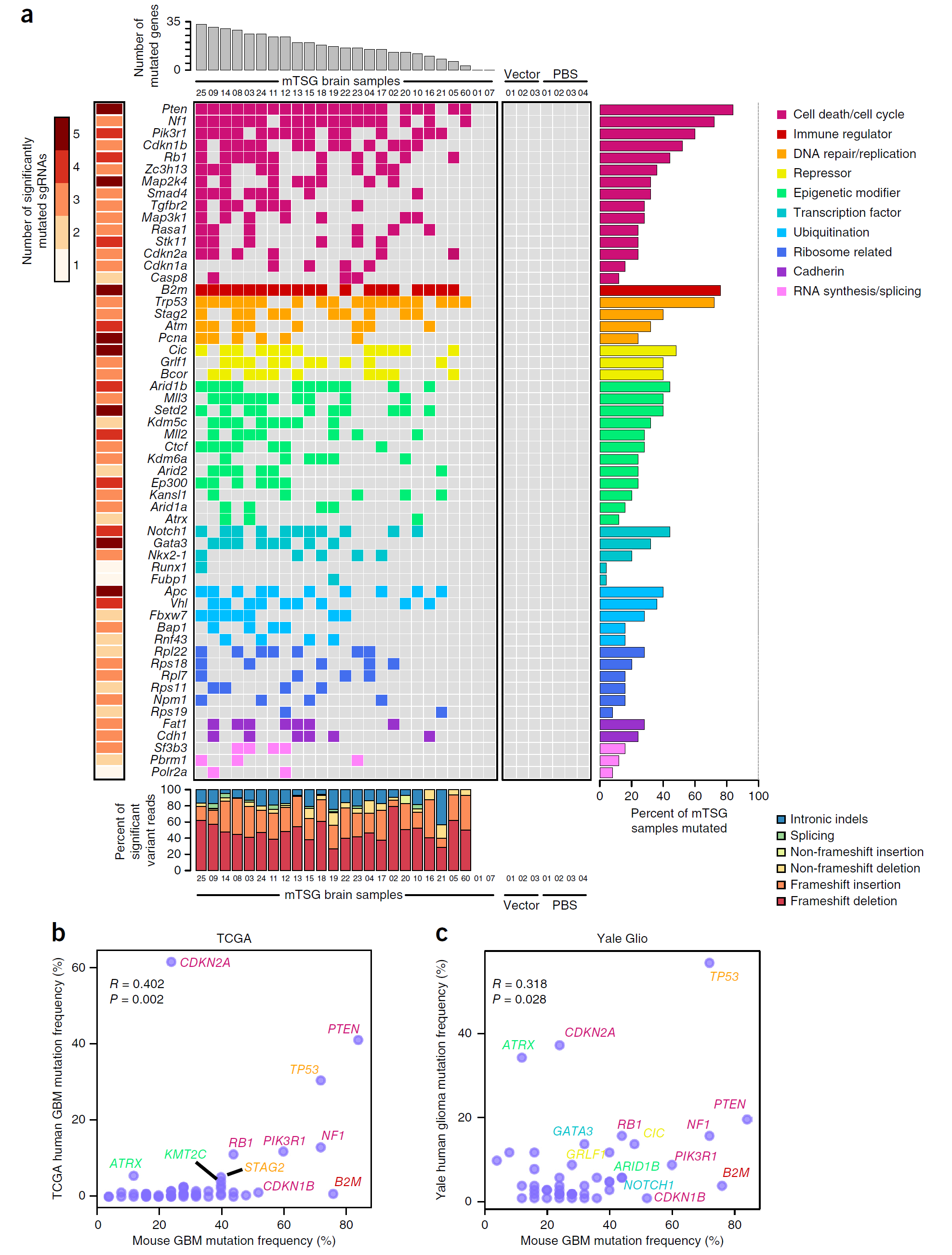
通过癌症图谱分析,以及与耶鲁大学胶质瘤细胞库的比对,作者分析了突变基因的功能,作者证实AAV-CRISPR系统构建的原位胶质母细胞瘤小鼠模型能够定量发现关键的肿瘤抑癌基因靶点(图5)。
通过并发突变分析,作者从总计1540对潜在突变基因中筛选到76对具显著意义的突变基因,且这些基因也同时在人胶质母细胞瘤患者脑中发生共同突变(图6),例如RB1和TP53, PTEN和RB1, RASA1和STK11等共同突变。
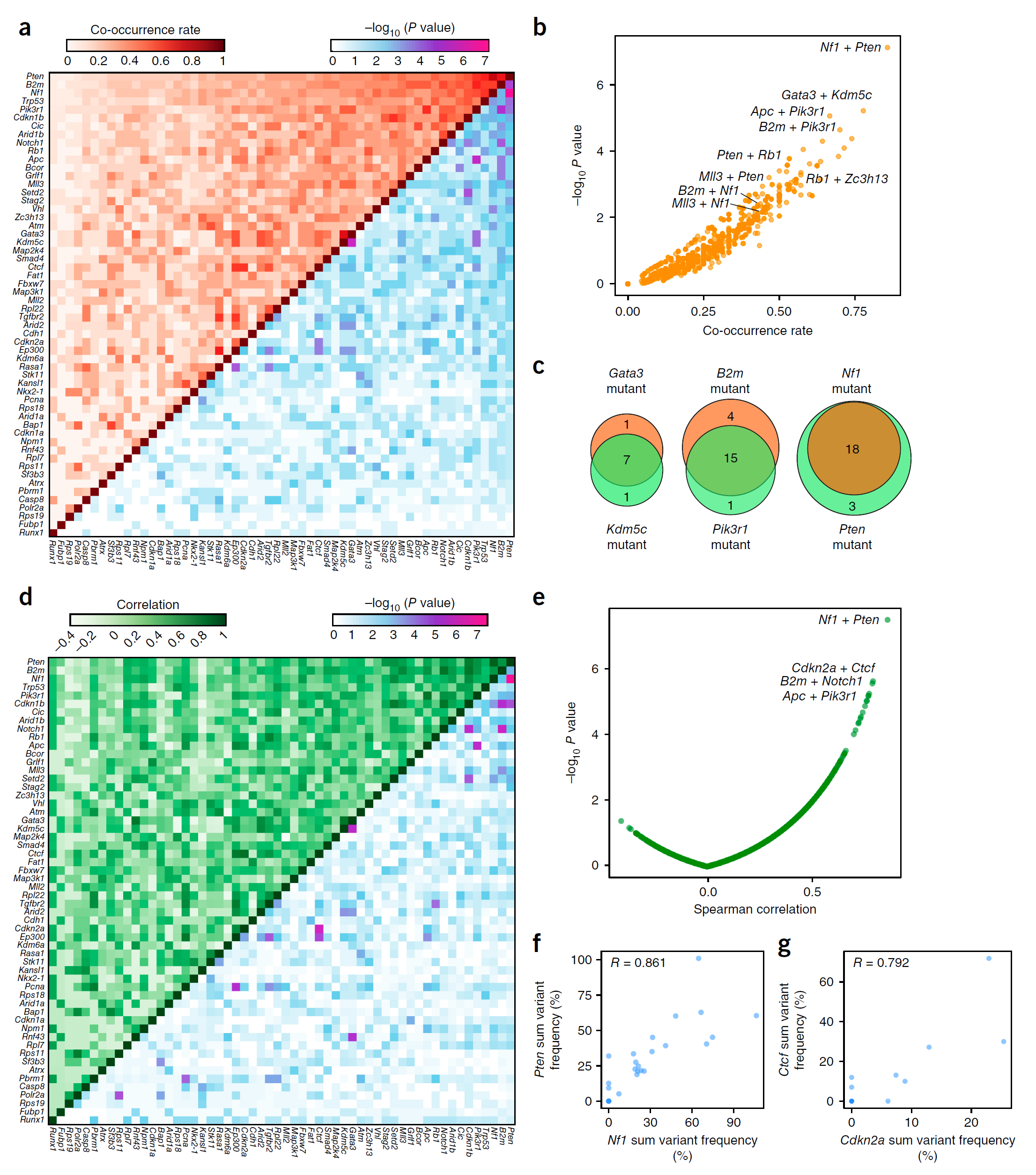 图6 并发突变分析找到同时突变的关键基因
5. sgRNA Minipool技术验证突变靶点
图6 并发突变分析找到同时突变的关键基因
5. sgRNA Minipool技术验证突变靶点
接下来,作者利用sgRNA迷你突变库检测前文发现的高代表性突变基因或共同突变基因的功能,策略如图7a,发现多个或多对突变基因确实能够诱导胶质母细胞瘤的产生(图7)。
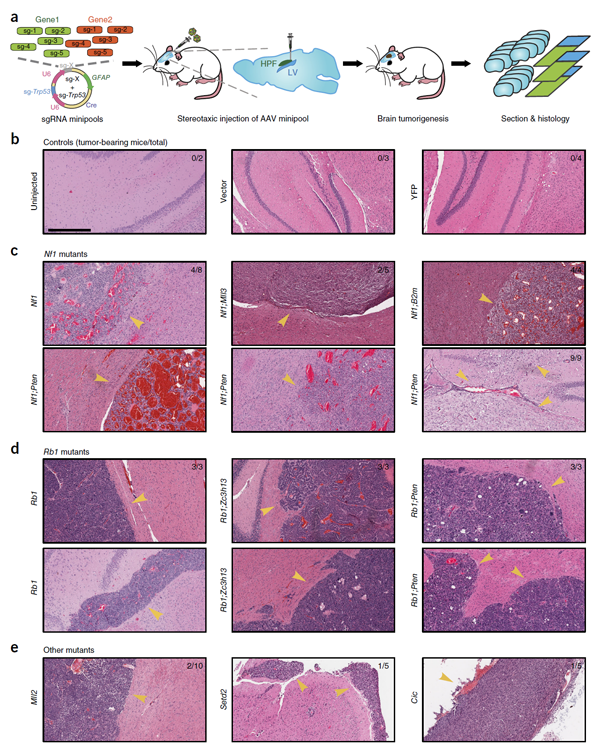 图7 sgRNA Minipool技术验证突变靶点的致癌
6. 转录组分析胶质母细胞瘤不同突变细胞的转录特性
图7 sgRNA Minipool技术验证突变靶点的致癌
6. 转录组分析胶质母细胞瘤不同突变细胞的转录特性
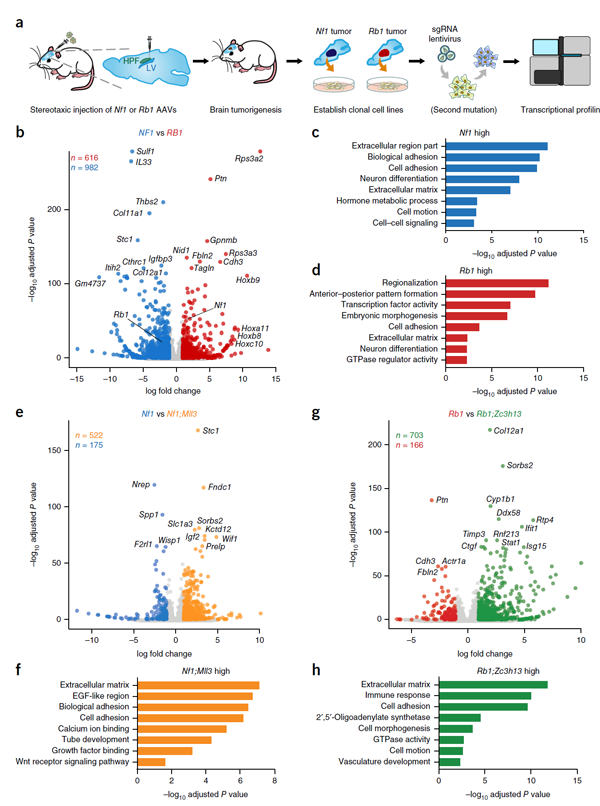
通过对不同突变基因导致的胶质母细胞瘤进行mRNA测序,作者鉴定了不同突变细胞的转录特性(图8)。例如,通过比较Rb1和Nf1突变细胞,作者发现了616个和982个在Rb1细胞和Nf1细胞高表达的基因(图8b)。通过大量的分析,包括共同突变,他们发现Mll3突变会明显影响Nf1突变细胞的转录组表达,而Zc3h13基因突变则会明显影响Rb1突变细胞的表达。
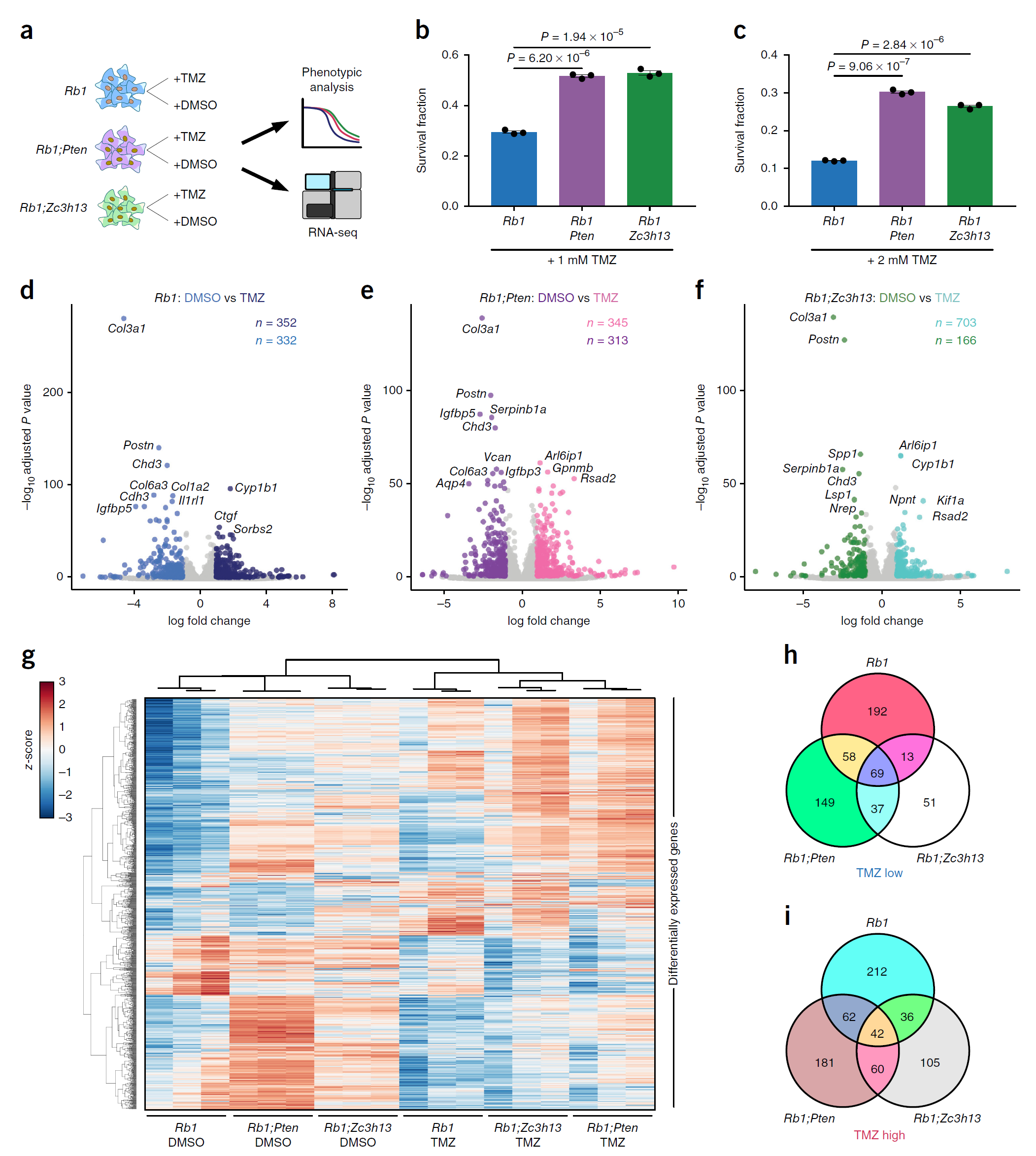
文末,作者设计了药物治疗的RNA测序实验(图9),结果发现Rb1突变的胶质瘤细胞中Zc3h13或Pten基因突变会增加TMZ化疗药物的耐药性,这提示未来的癌症需要考虑不同突变基因的耐药性问题。
利用AAV病毒载体,搭载CRISPR基因编辑技术,作者构建了一套极具特色的体内抑癌基因筛选策略,为未来癌症突变基因的筛选提供了新的办法。我们恭喜Chen教授的优秀工作顺利发表,希望未来有更多的重磅发现能够帮助人类对抗癌症。
参考文献: