
文献速递 | 转录组多组学在免疫调控中的应用
本期收录了近期关于转录组多组学技术在免疫调控中的应用相关高分文章。
组学促销
和元生物现推出组学活动促销(Illumina)
1. 真核有参转录组(6G) 549元/样
2. miRNA测序(10M) 1400元/样
转录组多组学它可以结合蛋白组学、代谢组学、表观遗传学等多个层面的数据,从而提供更全面、深入的信息,有助于理解免疫系统的复杂性和调控网络,以探索免疫调控的分子机制和生物学过程。通过转录组学分析,可以鉴定在免疫细胞中不同生理或病理状态下差异表达的基因,从而发现调控免疫过程的关键基因和信号通路,鉴定与免疫疾病相关的潜在生物标志物,从而促进早期诊断和治疗的发展。结合多组学的数据可以进行网络分析和功能注释,揭示免疫调控相关基因和它们相互作用和调控机制,以及其在免疫过程中的功能和调节作用。深入研究免疫系统的分子机制和调控网络。这种综合方法有助于揭示免疫细胞功能、寻找新的治疗靶点和开发个体化免疫治疗策略。
1 .活性嗜酸性粒细胞调节结肠炎的宿主防御和免疫反应

Active eosinophils regulate host defence and immune responses in colitis
发表期刊:Nature Communication
影响因子:16.6
发表时间:2023.3.18
DOI:10.1038/s41586-022-05628-7
摘 要
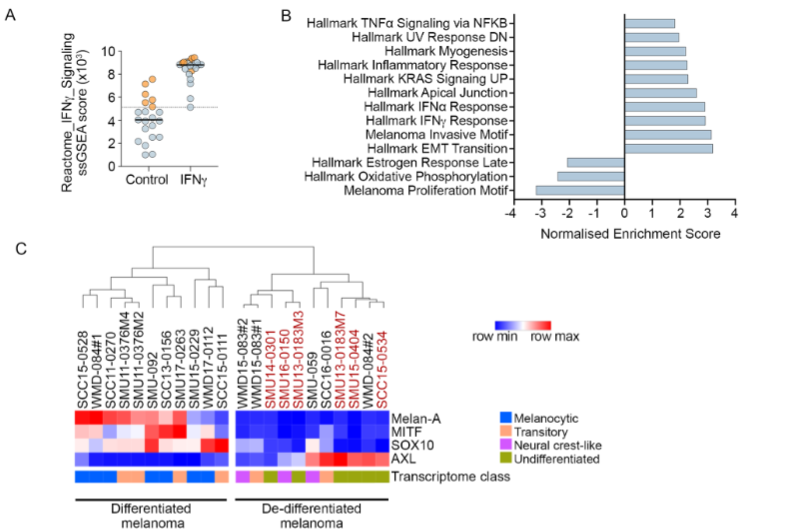
黑色素瘤患者对免疫检查点抑制剂疗法的耐药性很常见,这仍然是一个棘手的临床难题。在这项研究中,我们全面剖析了短期肿瘤细胞系和黑色素瘤患者在使用免疫检查点抑制剂治疗过程中产生的抑制剂耐药机制。结合基因组、转录组和高维流式细胞分析以及功能分析,我们确定了三种不同的免疫疗法耐药程序。研究发现:(1)肿瘤内在 IFNγ 信号传导和黑色素瘤去分化导致的野生型抗原表达缺失;(2)通过影响 MHC 表达的多种独立机制破坏抗原呈递;(3)PTEN 缺失相关的免疫细胞排斥。在黑色素瘤对免疫检查点抑制的耐药性中,抗原生成和递呈受损起着主导作用,这凸显了旨在恢复 MHC 表达、刺激先天性免疫和重新表达野生型分化抗原的治疗挽救策略的重要性。
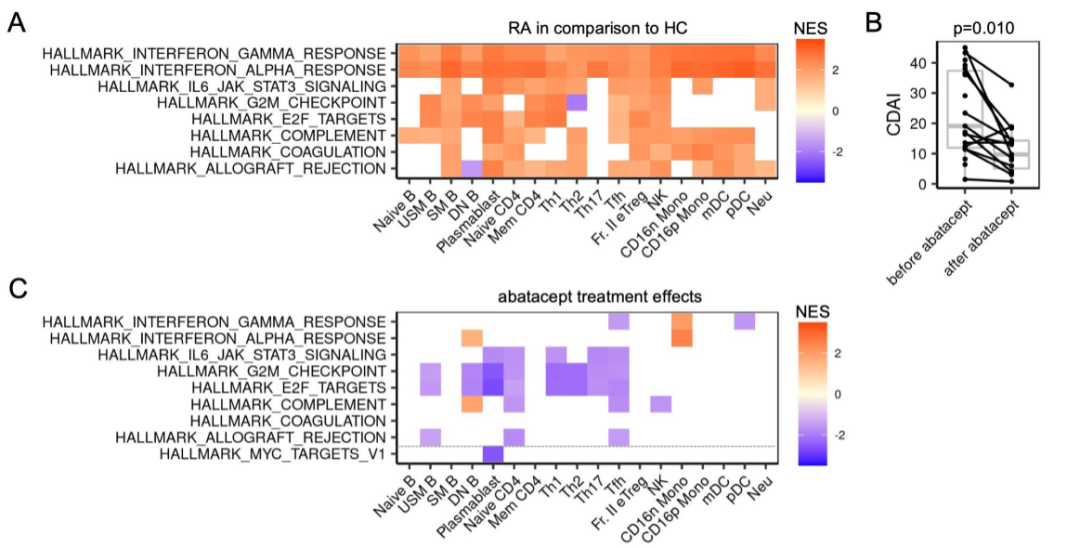
2 .类风湿性关节炎的免疫学分析确定前体树突状细 胞是治疗耐药性的关键细胞亚群

Immunomics analysis of rheumatoid arthritis identified precursor dendritic cells as a key cell subset of treatment resistance
发表期刊:Annals of the Rheumatic Diseases
影响因子:27.4
发表时间:2023.6
DOI:10.1136/ard-2022-223645
摘 要
关于类风湿性关节炎(RA)中潜在的可变治疗反应的免疫学知之甚少。我们对外周血免疫细胞亚群进行了转录组分析和质谱细胞术,以鉴定预测治疗耐药性的免疫细胞。
我们分离了18名需要增加新疗法的RA患者的55个外周血免疫细胞亚群和39名健康对照,并进行了RNA测序。系统表征RA的转录组变化和治疗效果。评估免疫细胞基因模块与治疗耐药性之间的关联。我们使用定量PCR(qPCR)和质谱细胞术分析队列验证了已确定的治疗耐药性参数的预测价值。我们还通过滑膜单细胞RNA测序分析表征了已鉴定的群体。结果发现RA患者的免疫细胞特征为干扰素增强和IL6-JAK-STAT3信号传导,显示治疗后部分正常化。反映树突状细胞前体(pre-DC)扩增的浆细胞样树突状细胞(pDC)的基因表达模块与治疗耐药性表现出最强的相关性。I型干扰素信号传导与DC前基因表达呈负相关。独立队列中的qPCR和质谱细胞术分析证实,在治疗前,难治患者的前DC相关基因表达和前DC的比例显着更高。一组滑膜 DC 表现出前 DC 和促炎常规 DCs 的两种特征。
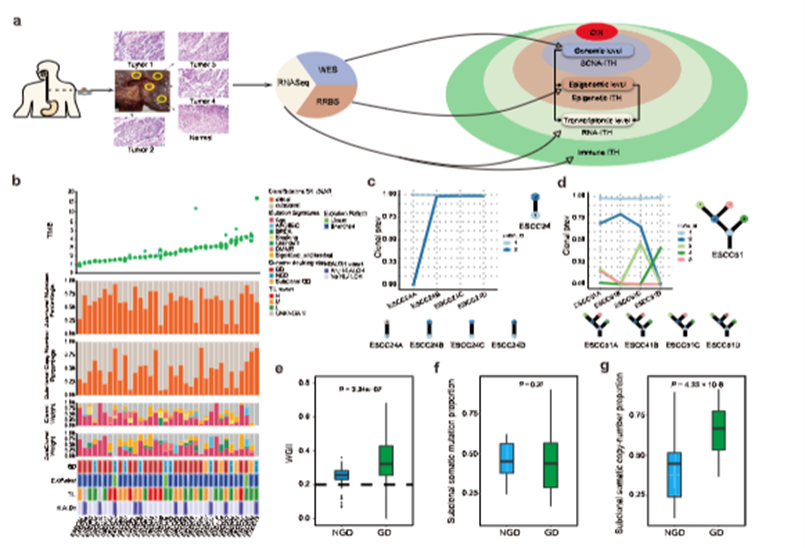
3 .肺泡巨噬细胞的训练免疫通过 KLF4-MERTK 介导的流出细胞作用增强了损伤缓解能力

Trained immunity of alveolar macrophages enhances injury resolution via KLF4-MERTK-mediated efferocytosis
发表期刊:Journal of experimental medicine
影响因子:15.3
发表时间:2023.11
DOI:10.1084/jem.20221388
摘 要
最近的研究表明,通过反复的有害刺激训练组织驻留巨噬细胞等先天性免疫细胞,可以增强宿主的防御反应。然而,组织驻留巨噬细胞经过训练后的免疫能力是否也能增强损伤的解决能力,从而抵消炎症反应的增强,这一点仍不清楚。在这里,我们研究了预先用细菌内毒素或铜绿假单胞菌挑战的肺驻留肺泡巨噬细胞(AMs),观察到这些训练有素的巨噬细胞对病原体诱导的细胞死亡表现出更强的复原力。转录组分析和功能测试表明,训练有素的AMs具有更强的细胞碎片排出能力和损伤消解能力。单细胞高维质谱分析和系谱追踪表明,训练可诱导具有促溶解表型的MERTKhiMarcohiCD163+F4/80-low肺驻留AM亚群扩增。重新编程后的AM在转录因子KLF4的介导下上调了排泄受体MERTK的表达。受体小鼠暴露于致命的铜绿假单胞菌后,这些训练有素的AMs的采纳性转移限制了受体小鼠的肺部炎症损伤。因此,我们的研究发现了组织驻留的训练有素的巨噬细胞亚群,它们能在病原体反复挑战后防止过度炎症并恢复组织稳态。
参考文献
Yamada S, Nagafuchi Y, Wang M, Ota M, Hatano H, Takeshima Y, Okubo M, Kobayashi S, Sugimori Y, Masahiro N, Yoshida R, Hanata N, Suwa Y, Tsuchida Y, Iwasaki Y, Sumitomo S, Kubo K, Shimane K, Setoguchi K, Azuma T, Kanda H, Shoda H, Zhang X, Yamamoto K, Ishigaki K, Okamura T, Fujio K. Immunomics analysis of rheumatoid arthritis identified precursor dendritic cells as a key cell subset of treatment resistance. Ann Rheum Dis. 2023 Jun;82(6):809-819. doi: 10.1136/ard-2022-223645. Epub 2023 Mar 14. PMID: 36918189; PMCID: PMC10314026.
Chakraborty S, Singh A, Wang L, Wang X, Sanborn MA, Ye Z, Maienschein-Cline M, Mukhopadhyay A, Ganesh BB, Malik AB, Rehman J. Trained immunity of alveolar macrophages enhances injury resolution via KLF4-MERTK-mediated efferocytosis. J Exp Med. 2023 Nov 6;220(11):e20221388. doi: 10.1084/jem.20221388. Epub 2023 Aug 24. PMID: 37615937; PMCID: PMC10450795.
# END #
// 免责声明
* 文章内容来源于“元莘生物 Origingene”公众号,转载文章仅供分享,如有涉及版权问题,请及时与我们联系,我们将给予删除或下线处理。
业务咨询
更多活动详情可咨询(微信/电话):15800353038

扫一扫,反馈当前页面
和元生物