
Nat Commun : 武汉大学郑凌团队发现脂肪褐变新靶点
脂肪组织(WAT)是全身性能量代谢的关键器官, 脂肪组织功能紊乱与肥胖和二型糖尿病相关的代谢疾病密切相关。脂肪细胞是脂肪组织中的主要细胞类型, 可以被分为白色脂肪细胞, 米色脂肪细胞和棕色脂肪细胞, 在冷刺激下, 具有棕色脂肪产热表型的米色脂肪细胞会被诱导褐变。白细胞介素10 (IL10) 是免疫细胞分泌的一种抗炎细胞因子, 可以通过与在成熟脂肪细胞表达的受体IL10rα结合, 抑制产热功能。
许多表观遗传因子能够参与产热调控。然而, 作为染色质结构和动力学的关键调节因子, 组蛋白变异在脂肪组织中的作用尚不清楚。此前, macroH2A1.1在白色脂肪细胞分化中的关键作用已被报道, 突变的组蛋白H3.3在褐色前体脂肪细胞中的过表达会损害小鼠褐色脂肪细胞的发育, 这表明组蛋白变异可能参与了代谢稳态的调节。连接组蛋白突变体 (H1.2) 已经被报道在细胞凋亡, 自噬, DNA损伤, 肿瘤发生有关。然而, H1.2在新陈代谢中的功能,特别是在脂肪组织中的功能,仍然存在未知的。
2023年7月6日, Nature Communications刊登了武汉大学郑凌教授团队在脂肪组织领域的研究成果“Linker histone variant H1.2 is a brake on white adipose tissue browning”,研究团队通过RNA-sequence, ChIP-sequence,基因敲除, 过表达等多种手段结合, 发现了H1.2通过结合编码IL10受体的IL10rα启动子, 抑制产热基因的表达从而抑制米色脂肪组织产热。

01.脂肪组织产热闸口新靶点H1.2的发现
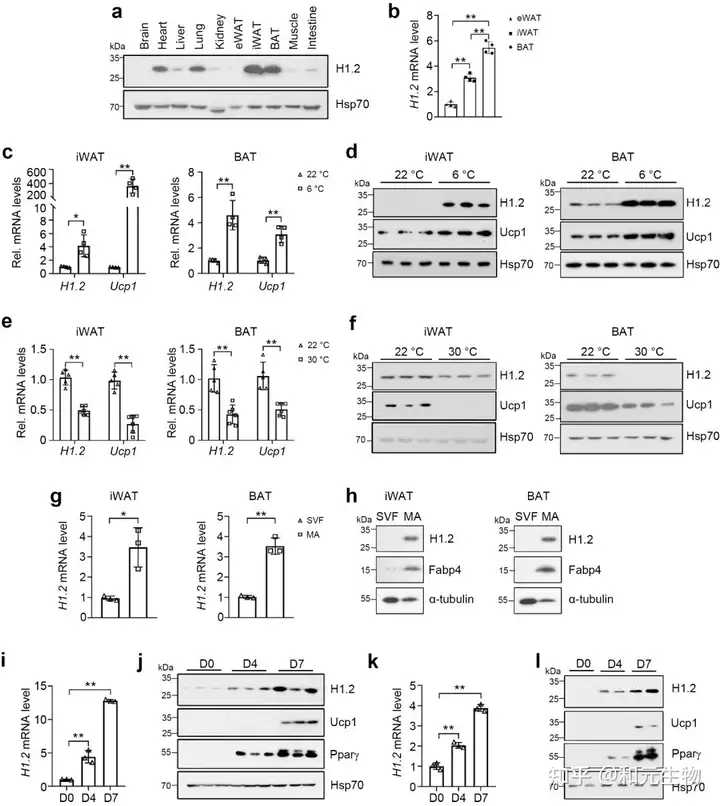
首先,研究者通过对十周龄雄性小鼠各组织的H1.2 进行蛋白含量测定, 发现H1.2在脂肪细胞中的表达量远高于其它组织 (图1a), 棕色脂肪组织 (BAT) 表达量最高, 腹股沟白色脂肪组织 (iWAT) 表达量其次, 附睾白色脂肪组织 (eWAT) 表达量最低 (图1b)。iWAT和BAT中的H1.2和解偶联蛋白1 (Ucp1) 的基因和蛋白表达量在低温(6℃, 22℃)下高于高温(22℃, 30℃)(图c-f), 同时, 其表达量随着脂肪分化程度和成熟程度逐渐升高 (图 g-l)。这些数据表明H1.2可能参与成熟米色和棕色脂肪细胞的适应性产热。
02.脂肪细胞特异性H1.2缺失促进能量消耗
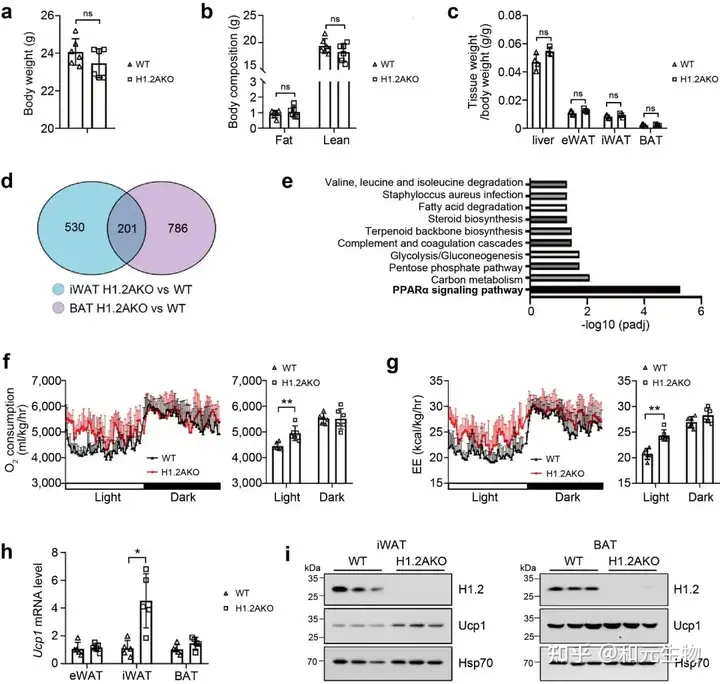
研究者进一步对小鼠脂肪组织中的H1.2进行基因敲除(H1.2AKO), 然后进行了RNA测序, 通过GO功能富集分析, 发现H1.2AKO小鼠中iWAT和BAT里面的差异基因主要参与PPARα信号通路, 与能量分解代谢密切相关 (图 2d-2e)。通过代谢笼实验, 发现H1.2AKO小鼠的氧气消耗量和能量消耗量高于WT小鼠, 白天作用更加显著 (图 2f-2g)。在H1.2AKO小鼠中, iWAT中的UCP1基因和蛋白表达量显著高于WT小鼠, 而BAT中的UCP1基因和蛋白表达量在H1.2AKO小鼠和WT小鼠中并没有显著区别 (图 2h-i)。这些数据表明H1.2缺失能够促进能量消耗, 并且在iWAT中发挥作用。
03.脂肪细胞中的H1.2在冷刺激下诱导iWAT褐变
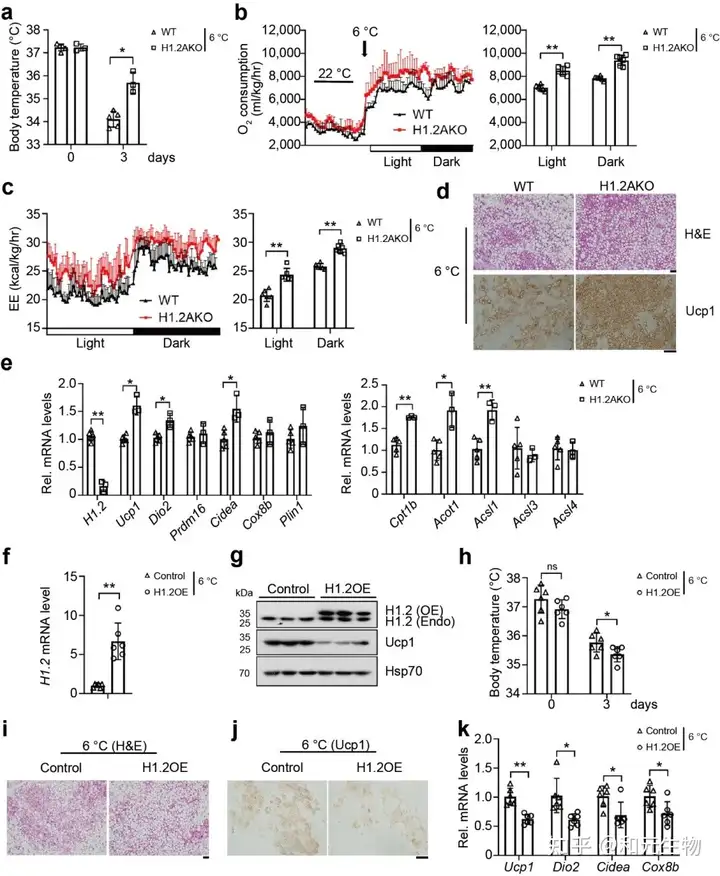
通过以上的研究, 可以推测出H1.2与iWAT产热有关。因此, 研究者将幼年H1.2AKO小鼠和WT小鼠在6℃下冷刺激3天, 发现H1.2AKO小鼠的体温升高, 氧气消耗增加, 能量消耗增加 (图 3a-c), 多腔的脂肪细胞增多, Ucp1表达量显著升高 (图 3d), 产热基因显著上调 (图 3e), 然而在冷暴露下的BAT中, H1.2AKO小鼠和和WT小鼠并没有显著区别。随后, 研究者对小鼠iWAT使用AAV作为载体进行H1.2过表达 (AAV-H1.2), 发现过表达H1.2组的小鼠iWAT中的Ucp1蛋白表达水平显著低于WT小鼠, 同样, 其体温显著降低, 表现出较低的耐寒性 (图 3f-h)。另外, 低温暴露后, H1.2 过表达小鼠的脂肪褐变受到抑制, Ucp1表达量降低, 产热基因的表达水平下降 (图 3i-k)。这些数据表明, 在冷暴露下, H1.2通过作用于iWAT而不是BAT, 作为适应性产热的负调节因子, 抑制iWAT褐变。
04.H1.2通过Il10rα调控米色脂肪细胞产热
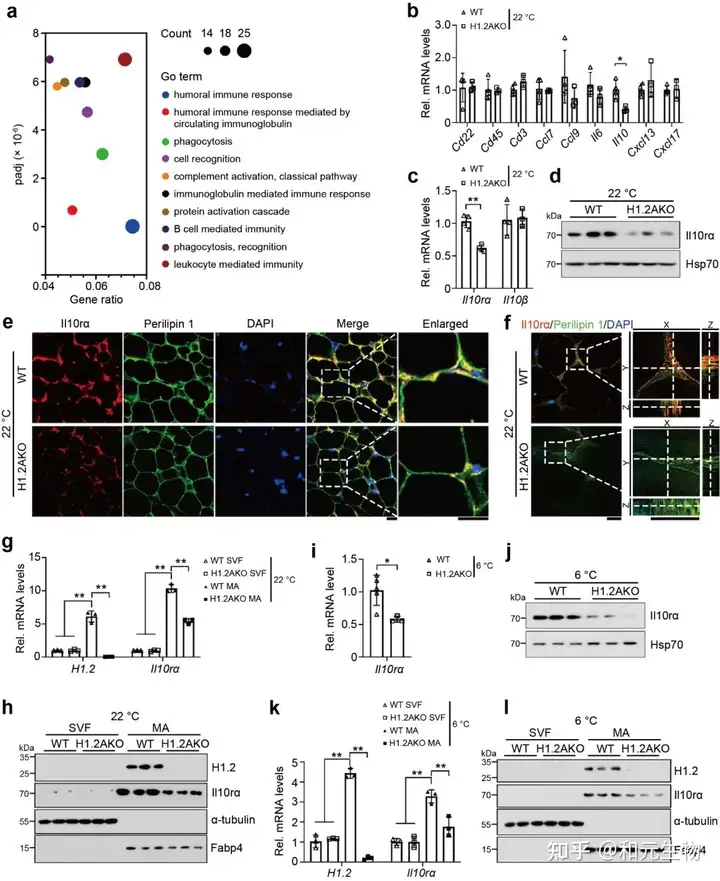
基于上一系列的研究结果, 研究团队通过对H1.2AKO鼠的iWAT进行GO 富集分析, 发现显著改变的基因主要涉及到体液免疫应答的生物学过程 (图 4a)。随后, 通过qPCR检测了B细胞, T细胞, 和与这些细胞相关的趋化因子的几种生物标志物, 结果并没有出现显著性差异。然而, 在H1.2AKO小鼠的iWAT中, 发现IL10, IL10rα的表达量显著降低, 其IL10rβ的表达量并未受到显著影响 (图 4b-f)。另外, 我们发现H1.2AKO小鼠中的iWAT中的成熟的脂肪细胞中IL10rα的基因和蛋白的表达显著低于WT组, 冷刺激下效果更加明显, 而iWAT中的血管基质部分并没有显著差异 (图 4g-i)。
使用Cre重组酶 (Ad-Cre-H1.2) 处理H1.2 flox/flox小鼠的脂肪细胞, 发现H1.2缺乏的成熟的米色脂肪细胞或棕色脂肪细胞中一些产热基因, 以及脂质β-氧化基因显著升高 (图 5a-e)。同时, Ucp1蛋白水平显著上调, IL10rα水平显著降低 (图 5f)。在H1.2缺陷米色脂肪细胞, 对其进行异丙肾上腺素处理, 同样发现IL10rα水平降低, Ucp1水平升高 (图 5g-h)。然而, 使用不同浓度的重组IL10蛋白来处理分化的米色脂肪细胞, 产热基因和蛋白的水平均下降, 在敲除H1.2后, IL10的这种产热抑制作用减弱 (图 5k-m)。这些数据表明, H1.2对于米色脂肪细胞的产热能力至关重要, H1.2 通过IL10rα 抑制产热。
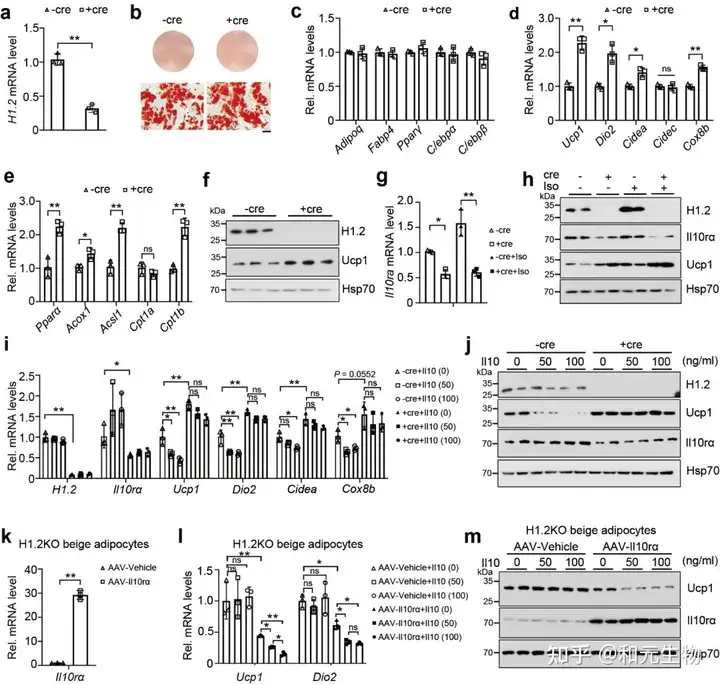
05.H1.2通过调节IL10rα影响冷诱导米色脂肪组织褐变
为了研究下调的IL10rα是否与冷刺激下H1.2AKO褐变有关, 在WT和H1.2 AKO小鼠的iWAT (AAV-Il10rα) 过表达Il10rα, 然后进行冷刺激, 通过qPCR, HE和免疫组化分析表明IL10rα的过表达减少了WT和H1.2AKO小鼠的iWAT的冷诱导褐变 (图 6a-g)。这些数据表明H1.2通过IL10rα抑制冷诱导的米色脂肪细胞产热。
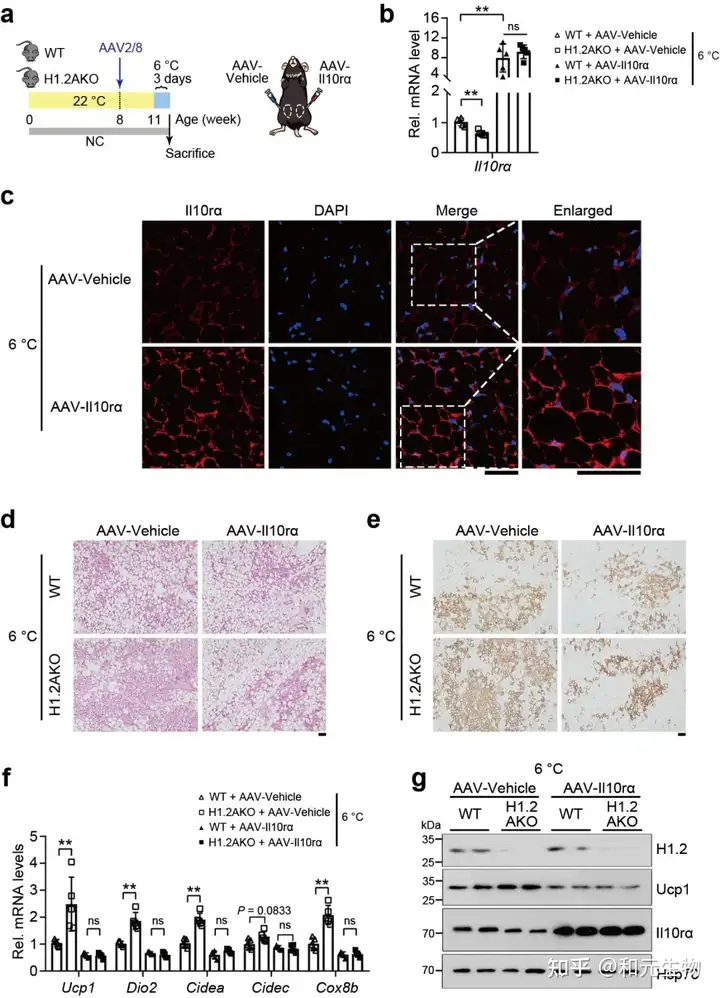
06.H1.2AKO小鼠能够通过IL10rα预防肥胖, 维持长期正常饮食状态下的能量稳态, 通过适应性产热减少体重增加
之前的研究表明, 米色脂肪细胞中H1.2参与产热, 因此研究者想要探究H1.2 AKO小鼠是否能够减轻脂肪堆积。研究者将H1.2 AKO和WT小鼠进行长期低脂饲养。结果表明, H1.2 AKO和WT小鼠的体重在刚开始没有明显差别, 但是18周龄时开始出现体重差异, 在28周龄时变得更加明显, H1.2AKO小鼠的脂肪质量和瘦肉质量增加较少 (图 7a-b)。另外, 28周龄的H1.2AKO小鼠的BAT和eWAT重量显著减少, 同时eWAT和iWAT的细胞大小变小 (图 7c-e)。在能量代谢方面, 28周龄的H1.2AKO小鼠, 氧气消耗和能量消耗增加, 葡萄糖耐量得到改善。同时, 在H1.2AKO小鼠的iWAT中, 脂肪生成基因下调, 产热基因和脂质β-氧化基因上调。这些结果表明H1.2AKO小鼠在长期低脂饲养后能够维持较好的代谢状态。
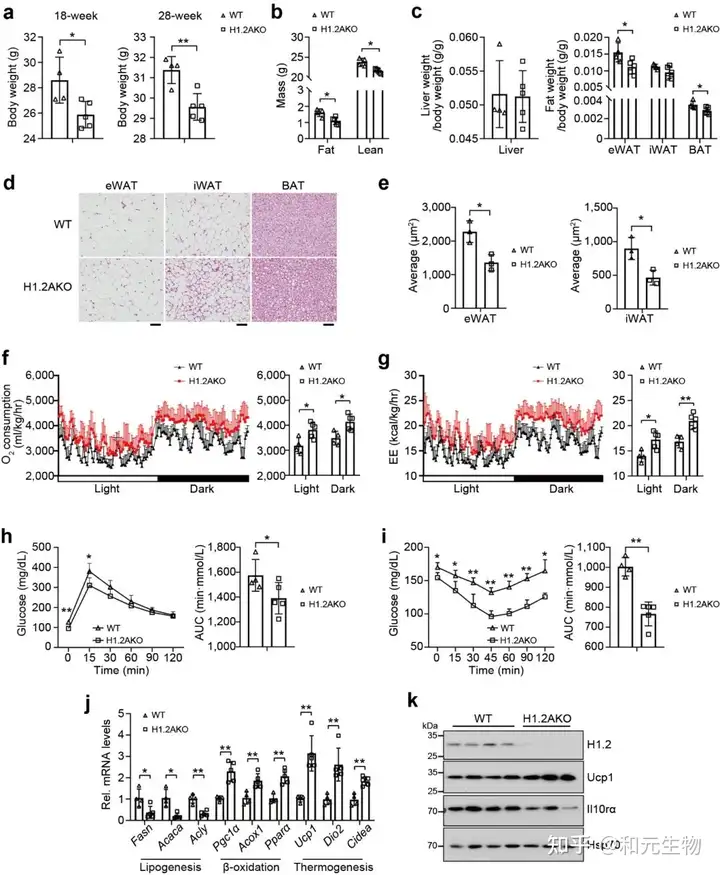
最近的研究表明, 与热中性条件 (30°C) 相比, 正常条件 (22°C) 对小鼠具有轻微的冷刺激。为了研究肾上腺素信号诱导的适应性产热是否有助于长期维持低脂喂养的H1.2AKO小鼠的代谢表型, 将22℃饲养4周的小鼠置于30°C环境4个月, 以尽量减少适应性产热, 发现H1.2AKO小鼠和WT小鼠的体重, iWAT, eWAT和肝脏重量没有显著差别, 但是其BAT重量显著降低 (图8b-e)。同样, 与脂肪生成, 产热和脂质β-氧化相关基因的转录水平没有显著差别 (图8f, g)。说明脂肪细胞H1.2缺乏通过适应性产热减少体重增加。
随后, 研究了高脂饲料喂养是否会影响热源性脂肪组织中H1.2的表达, 高脂饲养6个月后, 与低脂饲料喂养小鼠相比, iWAT和BAT中H1.2 mRNA和蛋白水平均升高 (图 9a-c); 同样, 不同体重指数的人体受试者的皮下脂肪中的H1.2基因和蛋白水平上调 (图9d)。回归分析表明BMI与皮下脂肪中 H1.2 mRNA水平呈正相关 (图 9e); 另外, H1.2AKO小鼠能够明显的缓解长期高脂饲养导致的体重, 脂肪重量的增加, 并且能够显著降低脂肪细胞大小, 增加能量消耗, 改善葡萄糖耐量, 增强胰岛素敏感性 (图 9d-k)。说明脂肪细胞中H1.2的缺失可以预防高脂饮食诱导的肥胖。
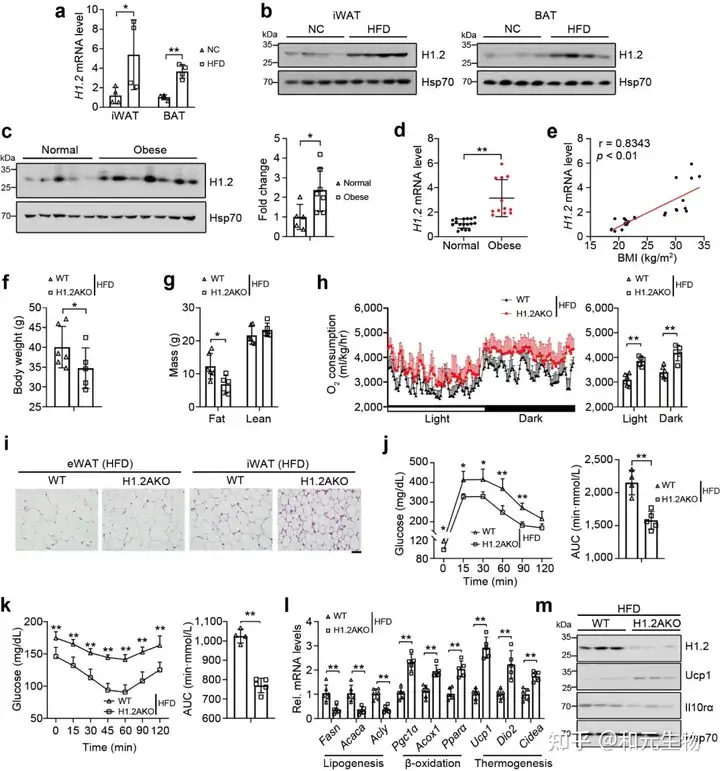
接下来, 研究者评估了H1.2是否依赖于IL10rα 抑制脂肪堆积, H1.2AKO和WT小鼠在低脂饲养10周后, 在iWAT中注射AAV-IL10rα, 再继续低脂饲养15周, 结果表明, Il10rα过表达可减弱脂肪细胞H1.2缺失对小鼠体重, 脂肪重量和各类脂肪组织的抑制作用 (图 10a-e); 同样, 过表达IL10rα后, H1.2AKO小鼠对葡萄糖耐量改善和胰岛素敏感性增强作用也被消除 (图 10g-h), qPCR结果表明产热基因和脂质β-氧化基因的上调也被抑制, 耗氧量率和能量消耗也降低 (图 10i-j)。这些结果说明H1.2AKO小鼠通过IL10rα预防肥胖。
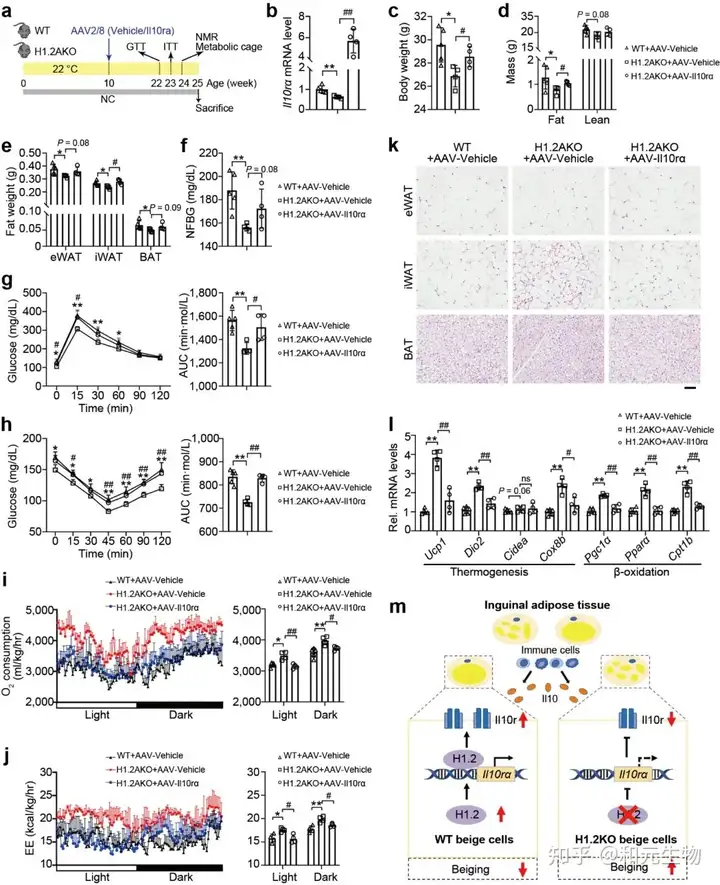
文章结论与展望
总的来说,作者抓住H1.2, 将H1.2与IL10免疫因子结合, 通过基因过表达, RNA-sequence, 代谢笼, IHC, ChIP-sequence, 基因敲除技术, 结合各种分子生物学手段深度解析了H1.2通过结合编码IL10受体的IL10rα启动子, 抑制产热基因的表达从而抑制米色脂肪组织产热。H1.2-IL10rα调控轴在肥胖中发挥重要作用, 敲除H1.2和IL10rα均能显著缓解肥胖, 提高产热, 诱导脂肪褐变以及改善葡萄糖耐量和胰岛素敏感性。因此H1.2和IL10rα可以作为潜在的治疗肥胖的靶点。
和元助力
和元生物有幸提供实验中使用的病毒包装(AAV-H1.2/AAV-IL10rα/Ad-Cre-H1.2)服务
业务咨询
更多活动详情可咨询(微信/电话):15800353038

扫一扫,反馈当前页面
和元生物