
【探秘GCT智造】从临床需求到2,000L大规模生产,基因治疗产能思考和工艺挑战分析
文章来自和元生物内容团队,转载请注明出处

浅析基因治疗行业产能需求与生产工艺挑战
近年来,依赖于基因载体的基因疗法和基因修饰的细胞疗法正在成为新型治疗手段而被广泛研究。基因治疗指修改人的基因以治疗或治愈疾病的技术,具体指的是将一种新的或经过改造的基因导入体内有助于治疗某种疾病,例如对致病基因的替换或者失活。基因治疗可分为体内基因治疗(将携带治疗性基因的病毒或者非病毒载体直接递送到患者体内,如AAV和溶瘤病毒)和体外基因治疗(将患者的细胞在体外进行遗传修饰后回输,如CAR-T免疫细胞治疗)。

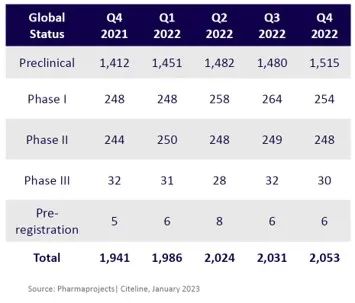
根据ASGCT 2022 Q4报告显示,截至2022年末,全球累计有2,053个基因治疗管线(包括基因治疗及基因修饰的细胞治疗),其中284个项目处于II期及之后,6个项目处于上市前注册阶段(NDA)。2022年,3款AAV基因治疗产品上市,分别是PTC公司开发的治疗AADC缺乏症的Upstaza,BioMarin公司开发的治疗A型血友病的ROCTAVIAN,以及CSL Behring & uniQure共同开发的治疗B型血友病的HEMGENIX。大量临床中后期的基因治疗产品,逐步加速上市的AAV基因治疗管线,共同催生了业界对大规模基因治疗产能的需求。
随着基因治疗行业的发展,对产能的讨论一直不绝于耳,本文浅析基因治疗行业的产能需求思考与生产工艺挑战。
基于AAV的基因治疗产品究竟需要什么样的产能需求
产能需求来自临床需求,目前的AAV基因治疗产品主要适应症包括眼科疾病、耳科疾病、血友病、肌肉骨骼疾病、心血管疾病、神经系统疾病、代谢疾病等。根据适应症的不同,AAV的临床用药方式迥异,但多以脏器原位注射(如视网膜下注射、脑内注射等)和系统注射(如静脉注射、脑脊液注射)为代表。

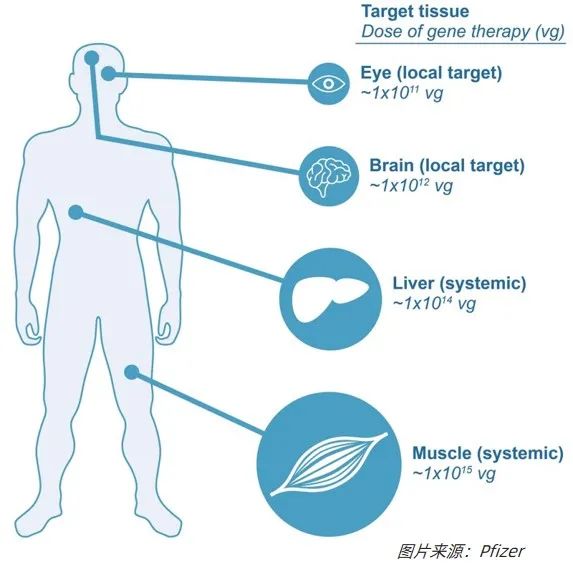
在不同的注射方式中,AAV的临床用量差异较大,根据Pfizer公司的一份报告显示:
1、为局部注射而生产的 AAV,例如在眼科适应症中,只需要大约每剂约1011的病毒颗粒 (vg),例如,Luxturna的剂量是每只眼睛1.5×1011vg;
2、为脑内注射的而准备的AAV载体则需要约1012的病毒颗粒(vg);
3、为全身递送而生产的 AAV,估计需要每剂1014-1015的病毒颗粒(vg),例如,对于Zolgensma,9公斤的患者需要1015病毒量,而治疗杜氏肌营养不良症 (DMD)的患者可能需要4×1015病毒量。
根据临床用量来计算生产需求,我们可以得知。对于眼科等局部病毒递送的适应症而言,只需生产1016-1017vg病毒即可满足10,000名患者接受基因治疗疗法;但是,对于大量的需要全身递送载体的基因治疗适应症,如血友病,则需要生产1019-1020的病毒才能够满足10,000名患者接受基因治疗疗法,这对于目前的AAV基因治疗产能而言是一个巨大的挑战。
根据CELL & GENE THERAPY INSIGHTS最近的一份综述分析,假设10,000名治疗杜氏肌营养不良症(DMD)患者接受AAV基因治疗疗法,按照目前的生产产率计算,该患者群体所需要的AAV总量大概需要80个3,000L一次性生物反应器,以每年20批次的效率来产出,大致相当于目前全球总产能的三倍。这凸显了目前基因治疗载体产能的严重不足,McKinsey于2022年的一份报告显示,全球病毒载体CDMO都在近几年投入重金扩大产能。
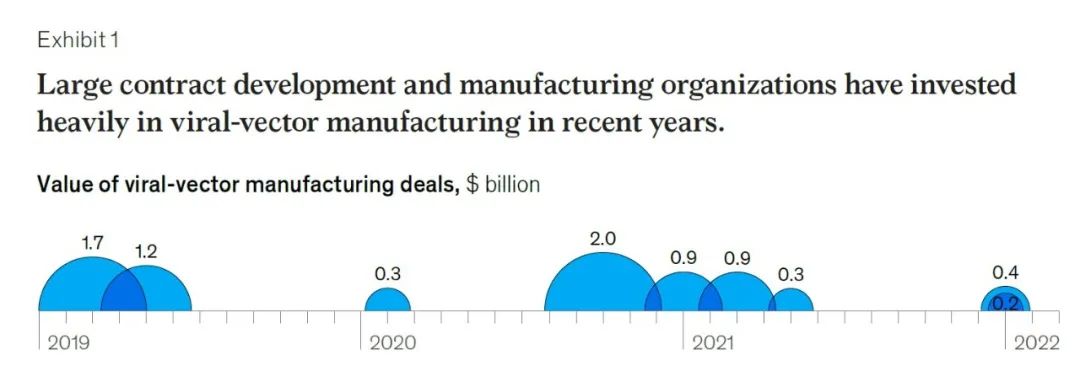
▲图片来源:McKinsey官网
解决产能困境的方式主要包括临床用量的降低和AAV生产能力的提升,前者的解决方案依托对AAV递送效率的提升和研究,下文重点分析如何通过先进工艺开发提高AAV产量,满足未被满足的临床需求。
AAV基因治疗产品GMP生产的工艺开发要点
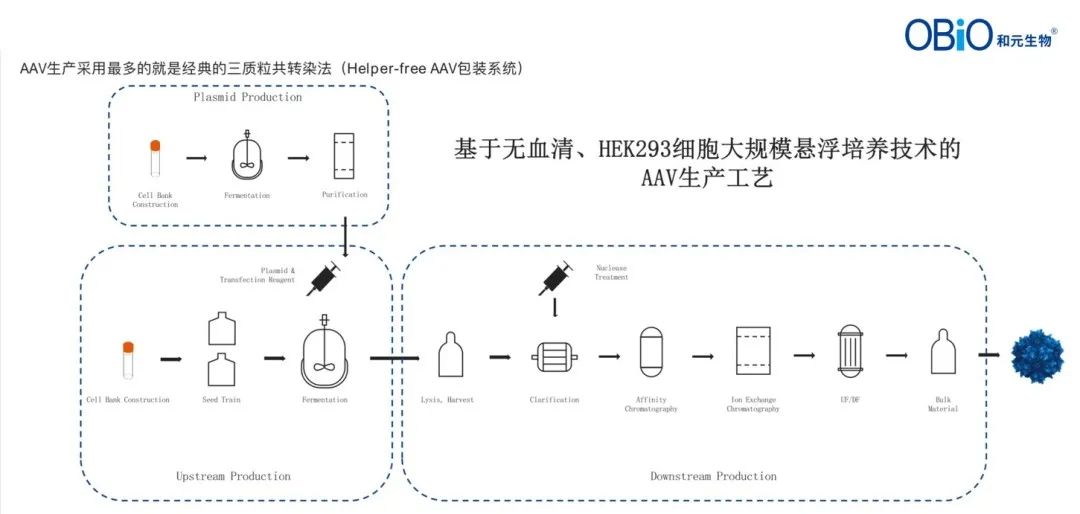
AAV的生产工艺主要包括上游细胞培养(以经典的三质粒转染哺乳动物细胞生产体系为例)和下游病毒纯化工艺,提高上游产量和下游得率是AAV生产工艺开发的重点。
1 优化细胞培养方式,主要分为悬浮培养和贴壁培养
两类方式有着各自的优缺点:悬浮培养的无菌控制简单,放大难度中等,放大规模大;微载体培养的无菌控制简单,放大规模也大,但是其放大难度高;细胞工厂培养放大难度低,但难以无菌控制和放大规模有限;滚瓶培养与细胞工厂培养特点类似;固定床培养无论是无菌控制,还是放大难度和规模都处于中等程度。
早期AAV产品的病毒载体培养方式采用贴壁培养为主(如细胞工厂),随着技术进步和工艺提升,基于无血清、HEK293细胞的大规模悬浮培养技术,凭借可放大性好、灵活性高的优势成为AAV大规模GMP生产的关键工艺。此类生产中,提升单细胞产量是AAV生产的关键,工艺开发者需要通过建立转染方案、优化培养条件、控制细胞密度及聚集体,以实现细胞稳健生长、较高病毒滴度及较高实心率的达成。
2 优化下游收获和纯化工艺
如果所生产载体都表达在细胞外,则生产工艺相对简单,生产人员只需要收集细胞培养上清,配合下游纯化手段获得载体。然而,大部分基因治疗载体同时存在于胞内和胞外,因而要获得大量病毒,就必然涉及细胞裂解过程。病毒收获工艺复杂,其中涉及细胞与上清的分离,因此,优化病毒收获时间、裂解条件等,对于提升病毒得率同样重要。
在获得病毒混合液之后,生产人员还需要借助过滤、浓缩、层析三个环节完成病毒的下游纯化。过滤分成切向流过滤、深层过滤和表面过滤,目的是为了去除细胞、细胞碎片和沉淀聚集物。浓缩的目的是回收病毒载体,同时去除培养基中的盐类。层析技术则常通过离子交换层析、尺寸排阻层析等方式完成。
在层析精纯工艺中需要考虑电导优化,载体片段长度,洗脱条件等。在运用分子筛复合模式层析时,特别注意分子筛的孔径大小(标识孔径利用特定蛋白进行测试),提前用已有的病毒对孔径进行分析,否则病毒容易卡在分子筛中,造成产品损失。三种工艺需要相互配合,来确保病毒载体的纯度与数量。
3 基因治疗产品的大规模生产更加注重“质量源于设计”(“QbD”)的工艺开发理念
大规模生产成本高、周期长、难度大,对产品的质量控制同样有很大挑战,基于质量源于设计的理念开发生产工艺尤为重要。通过预先危害分析(PHA)风险评估筛选关键质量属性(CQA),工艺开发人员即可快速锁定关键参数开展优化工作。参数多种多样,包括病毒颗粒数、基因组滴度、残留核酸酶、残留质粒、宿主蛋白残留等,参数的好坏会直接影响产品在临床试验过程中的安全性与有效性。
▲图片来源:Kumar Sumit, et al., 2012
2,000L超大规模一次性工艺的基因治疗载体生产体系如何打造落地
目前,基于中小体系(50L-200L)悬浮细胞培养的AAV病毒载体生产已相对成熟,但面向未来基因治疗产品商业化的多样需求、大规模需求,药物开发者应考虑保证高产量和高可靠度的病毒载体大规模GMP生产体系,500L、1,000L、2,000L的生产体系正当时。
一次性使用系统因其污染风险少、清洁验证成本低、工艺转化和灵活性高等特点,在生物制药行业中得到了广泛应用, 帮助制药企业大大缩短生产时间,提高了药物研发速度。作为生物技术生产的核心,一次性生物反应器自然成为使用的焦点。
和元生物基于历史项目研发、生产经验,在即将开幕的和元生物临港产业基地布局全面的GMP级悬浮工艺大规模生产平台,可提供经济、高效、规模化的整体解决方案:

COMING SOON
和创新纪元
智愈未来 造就非凡
和元智造精准医疗产业基地开业盛典
2023年4月21日
中国·上海
感谢以下单位支持
香港奥星集团
楚天科技股份有限公司
赛多利斯斯泰帝(上海)贸易有限公司
赛默飞世尔科技 (中国)有限公司
上海多宁生物科技股份有限公司
上海凯贤流体科技有限公司
上海荟诚信息系统有限公司
格来赛生命科技(上海)有限公司
上海德卡实验室系统科技有限公司
上海宸芯环保科技有限公司
江苏启安建设集团有限公司
丁之洁团队 (现伍德中国生命科学事业部)

扫一扫,反馈当前页面
和元生物