
慢病毒系列 | 一文掌握原代神经元的基因调控策略
神经元即神经细胞,是构成神经系统最基本的结构和功能单位。大脑由大量相互连接的神经元组成,科学家们开展了大量的研究来解析关于神经元的奥秘。本文中,小编整理了病毒载体助力阿尔兹海默症、抑郁症以及大脑神经发育等相关研究成果,以期为科研人er提供新的研究思路!
1、原代海马神经元
文章标题:Intracellular accumulation of tau inhibits autophagosome formation by activating TIA1-amino acid-mTORC1 signaling
研究内容:自噬功能障碍与阿尔茨海默症
发表期刊:Mil Med Res IF:34.915
作者及单位:华中科技大学 王建枝教授
细胞类型:原代海马神经元(来源18d胎鼠)
病毒载体:Lenti-eGFP-hTau/ Lenti-eGFP-C1/ LentieGFP-P2A-hTau/ Lenti-eGFP-P2A-C1
自噬功能障碍在阿尔茨海默病(AD)的tau蛋白累积和神经变性中起着至关重要的作用。本研究旨在探讨tau蛋白的积累是否以及如何反过来影响自噬。研究表明通过过表达人类全长野生型tau蛋白模拟AD样tau蛋白累积可诱导自噬缺陷。增加的tau蛋白可以与T细胞胞内抗原1的朊病毒相关结构域(PRD-TIA1)结合,显著增加细胞间氨基酸水平,同时伴随mTORC1活性的上调,抑制自噬体形成。如预期,这种tau诱导的自噬体形成不足反过来加剧了tau的积累。重要的是,通过过表达PRD-TIA1阻断TIA1和tau的相互作用、通过shRNA下调内源性TIA1的表达、或通过小蛋白水解靶向嵌合体(PROTAC)下调tau蛋白水平,均可以显著减轻tau诱导的自噬损伤。
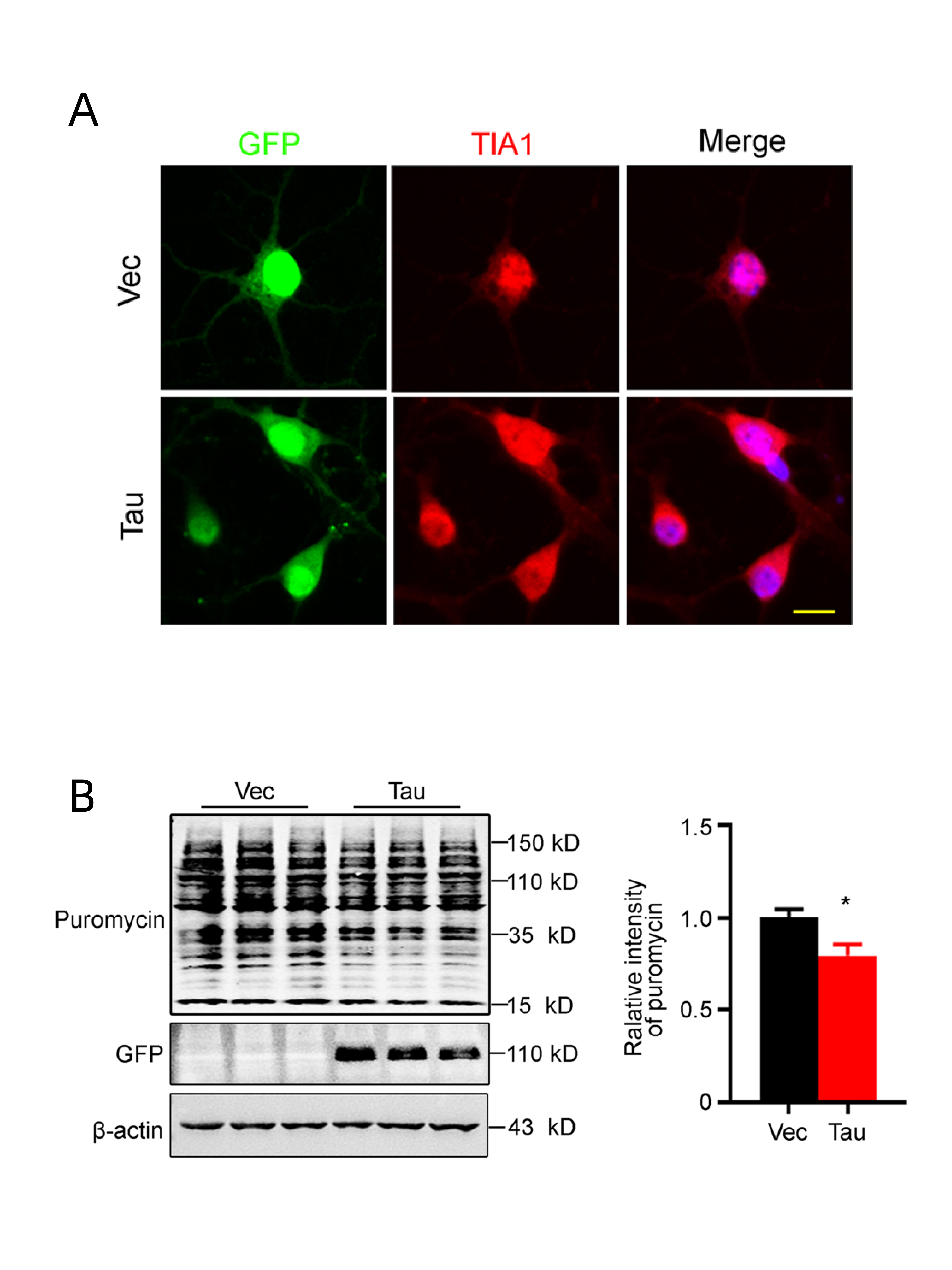
图1. Tau正向调节TIA1在海马神经元中的胞质定位(PMID: 35799293)
文章标题:Stress-induced reduction of Na+/H+ exchanger isoform 1 promotes maladaptation of neuroplasticity and exacerbates depressive behaviors
研究内容:抑郁症
发表期刊:Sci Adv IF:14.957
作者及单位:山东大学齐鲁医学院基础医学院 于书彦教授
实验动物:雄性Thy1-Cre小鼠
细胞类型:原代海马神经元(来源P1新生大鼠)
病毒载体:AAV2/9-CaMKIIα-NHE1 shRNA-eGFP/ AAV2/9-CMV-DIO-CUL4A-eGFP/ AAV2/9-CaMKIIα-hM4D(Gi)-mCherry/ AAV2/9-hSyn-DIO-hM4D(Gi)-mCherry/ LV-NHE1shRNA-eGFP/ LV-NC
抑郁症(Major depression disorder, MDD)是一种以特定脑区神经元活动异常为特征的神经精神疾病。细胞内pH(pHi)稳态是维持正常神经元功能的关键因素。研究发现慢性应激可诱导动物模型的抑郁样行为,并下调海马Na+/H+交换体1(NHE1)的表达,NHE1是神经元内pHi的主要决定因素。敲低海马CA1区锥体神经元NHE1导致细胞内酸化,促进树突棘丢失,降低兴奋性突触传递,增强大鼠对应激暴露的易感性。此外,E3泛素连接酶cullin4A可能促进NHE1的泛素化和降解,从而诱导不平衡的pHi对突触过程的影响。电生理数据也提示,神经可塑性适应不良导致的海马神经元兴奋性异常可能参与了MDD的发病机制。
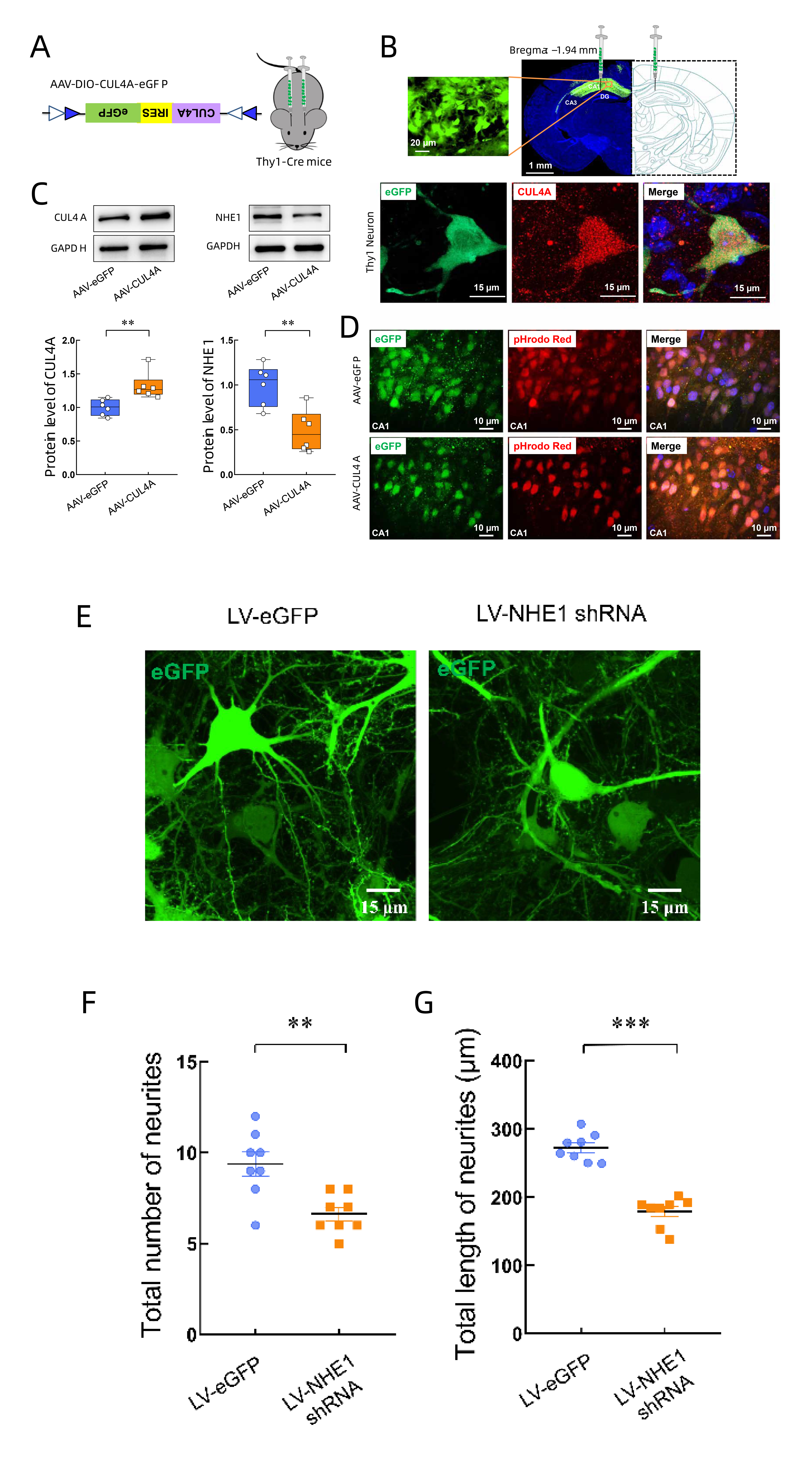
图2. AAV立体定位注射&LV体外感染神经元(PMID: 36367929)
文章标题:p85S6K sustains synaptic GluA1 to ameliorate cognitive deficits in Alzheimer’s disease
研究内容:阿尔兹海默症
发表期刊:Transl Neurodegener IF:9.883
作者及单位:上海交通大学医学院 邱瑜教授
细胞类型:原代海马神经元(来源新生24h的SD大鼠海马组织)
病毒载体:LV-OE-p70S6K/ LV-OE-p85S6K/ LV-OE-Flag-p85S6KT421A/ LV-NC
感染经验:MOI=4
核糖体蛋白S6激酶1 (S6K1)是一种丝氨酸-苏氨酸激酶,有两种主要亚型:p70S6K (70-kDa亚型)和p85S6K (85-kDa亚型)。p70S6K及其上游哺乳动物雷帕霉素靶蛋白(mTOR)已被证明参与学习和记忆,并参与阿尔茨海默病(AD)的病理生理过程。本文验证了p85S6K在突触后密集区中富集,敲低p85S6K会导致空间和识别记忆的缺陷。此外,p85S6K可以通过突触相关蛋白97和a激酶锚定蛋白79/150与AMPA受体的GluA1亚基相互作用。机制研究表明,p85S6K可以直接在Ser845磷酸化GluA1并增加突触中GluA1的数量,从而维持突触功能和脊柱密度。此外,我们发现p85S6K在AD患者和AD小鼠大脑的突触体室中特异性降低。过表达p85S6K可改善转基因AD模型小鼠的突触功能和认知功能障碍。这些发现为p85S6K作为AD治疗潜在靶点提供了一种见解。
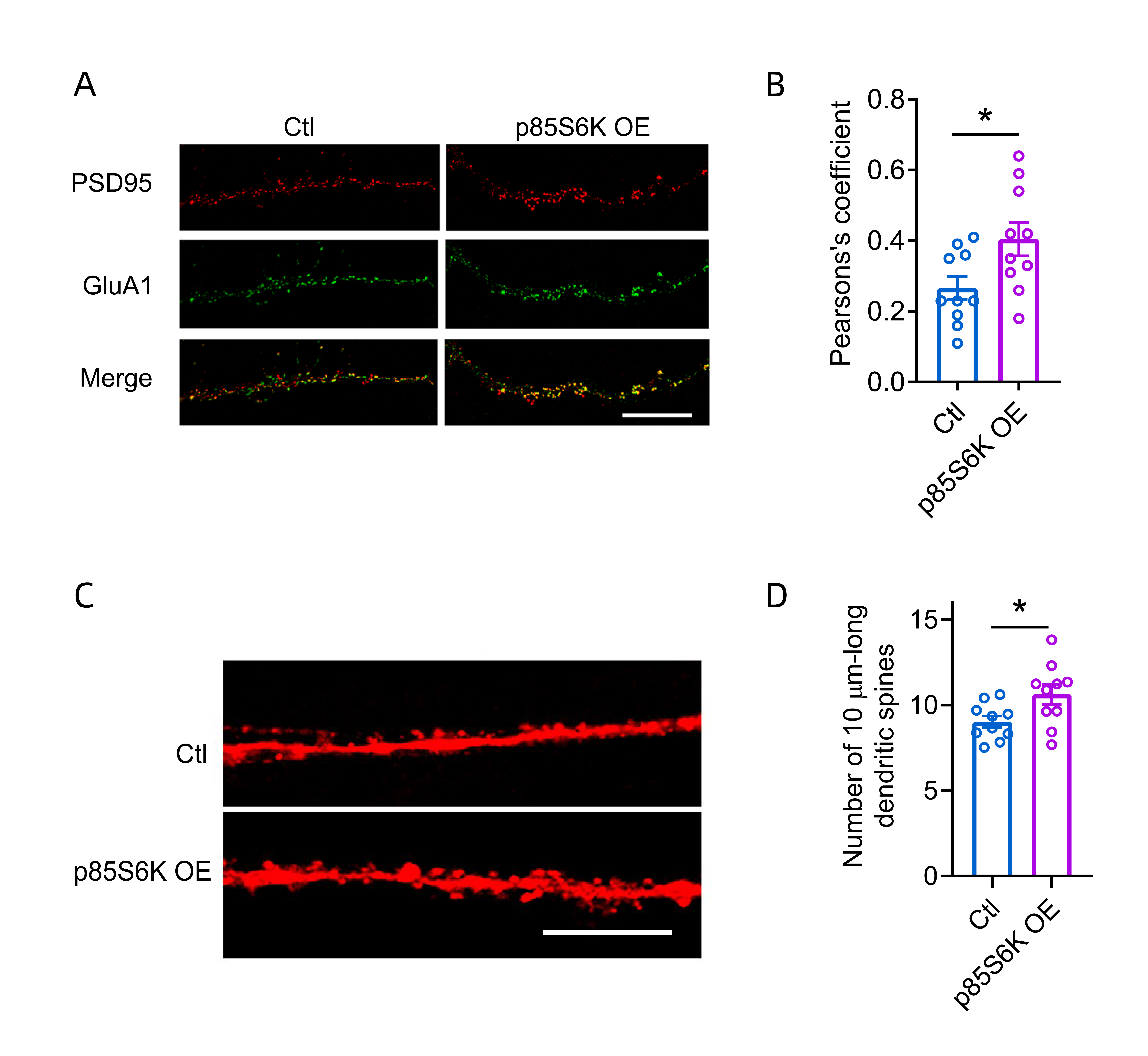
图3. p85S6K磷酸化GluA1并促进脊柱密度和突触强度(PMID: 36624510)
2、原代大脑皮层神经元
文章标题:Sevoflurane impairs m6A-mediated mRNA translation and leads to fine motor and cognitive deficits
研究内容:大脑神经发育
发表期刊:Cell Biol Toxicol IF:6.819
作者及单位:中国科学院上海药物研究所 冯林音研究员
实验动物:C57BL/J6小鼠
细胞类型:原代皮质神经元(胚胎期14.5d)
病毒载体:AAV-CMV-YTHDF1-3flag-2A-mcherry-wpre/ AAV-NC/ LV-FUGW-UBI-YTHDF1-3flag-2A-mcherry/ LV-NC
病毒用量:10 μL(1.99 × 1013 VG/mL)左心室注射AAV
在临床手术中发现,多次麻醉的患儿可能会导致认知和精细运动控制缺陷的风险增加,长时间麻醉的儿童在术后6个月时精细运动技能受损。研究发现YT521-B同源结构域家族1 (YTHDF1)是一种重要的N6基因编码蛋白,在多次七氟醚麻醉暴露后,YTHDF1在幼鼠前额叶皮质中显著下调。七氟醚导致小鼠皮质神经元的蛋白质合成减少可以通过YTHDF1得到挽救,这表明麻醉可能通过影响m6A依赖的mRNA翻译来影响早期脑发育。全转录组证明小鼠前额叶皮质中,突触前蛋白突触素被m6A甲基化特异性修饰并与YTHDF1相关,并且突触素的m6A甲基化随着七氟醚的多次暴露而降低。多次麻醉暴露的小鼠,精细运动控制技能和认知功能受损,而这些影响通过可通过血脑屏障(BBB)的病毒递送系统重新引入的YTHDF1完全逆转。研究揭示通过N6-甲基腺苷甲基化的mRNA翻译调节受损是麻醉影响年轻大脑神经发育的潜在机制。
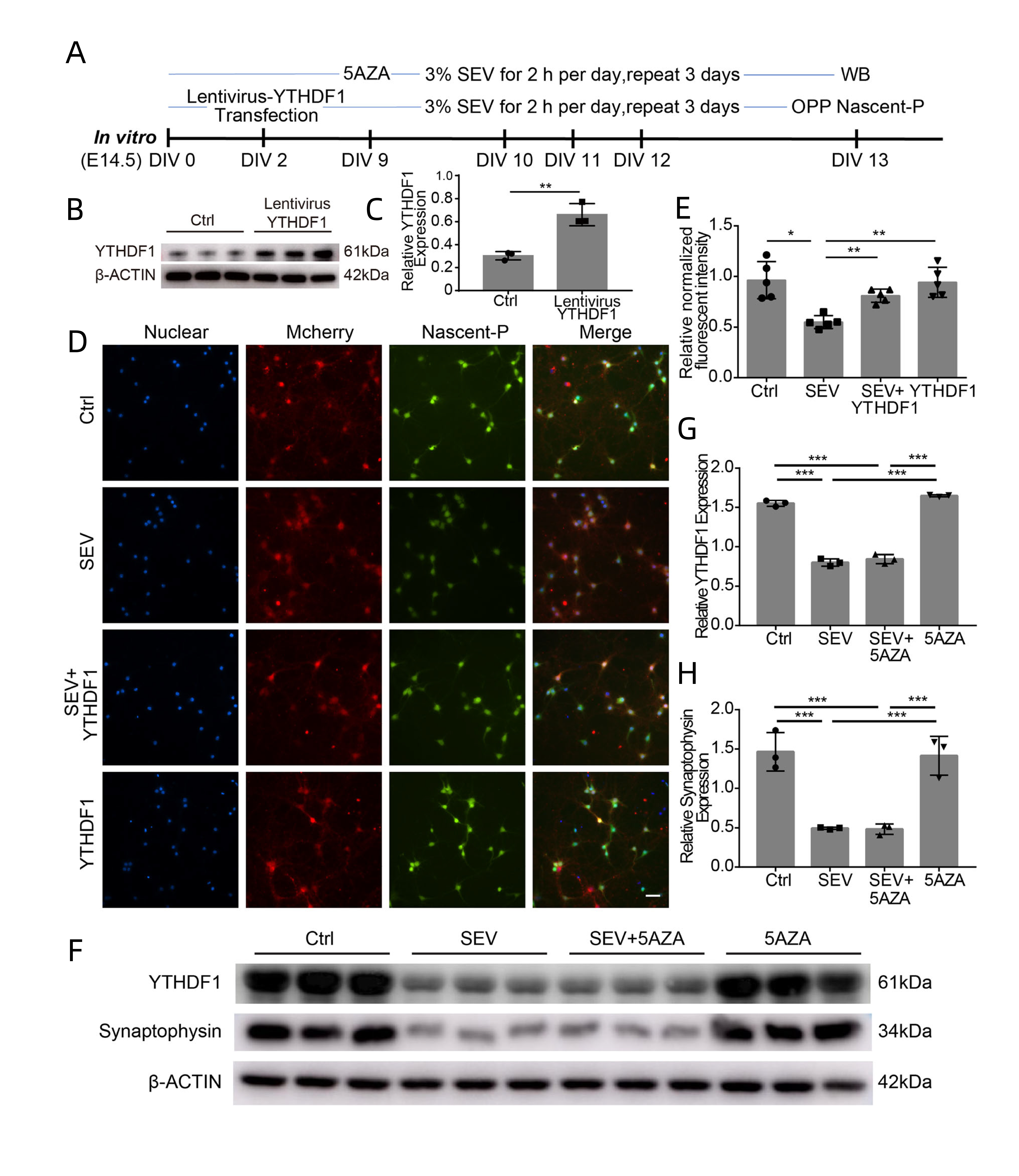
图4:七氟醚在体外抑制YTHDF1依赖性蛋白合成(PMID: 33928466)
文章标题:Pyk2 inhibition attenuates hypoxic-ischemic brain injury in neonatal mice
研究内容:新生儿缺氧缺血性脑损伤
发表期刊:Acta Pharmacol Sin IF:7.169
作者及单位:中国医学科学院北京协和医学院 陈乃宏
实验动物:CD-1幼鼠
细胞类型:原代皮质神经元(胚胎期14d)
病毒载体:pLKD-U6- Pyk2 shRNA-CMV-eGFP(8.12 × 108 TU/mL)/ pLenti-HIF-1α promoter-EGFP-3FLAG-micro30 shRNA(Pyk2 shRNA)(1.78 × 109TU/mL)/ LV-NC(6.55 × 108 TU/mL)
注射方式:侧脑室(ICV)注射 3μL
感染经验:MOI=40
新生儿缺氧缺血性脑损伤目前仍缺乏有效的治疗方法。富含脯氨酸的酪氨酸激酶2 (Proline-rich tyrosine kinase 2, Pyk2)是一种非受体酪氨酸激酶,与成人短暂性缺血性脑损伤高度相关。本文探讨Pyk2在新生儿HI脑损伤中的作用。采用单侧颈总动脉结扎+低氧暴露的方法建立7日龄小鼠HI模型。构建Pyk2干扰慢病毒(LV-Pyk2 shRNA),于HI前注射至新生小鼠单侧脑室。出生后8 ~ 14 d,观察大鼠脑梗死体积、病理学改变及神经行为学变化。结果发现Pyk2的磷酸化水平在新生儿HI后显著增加,而LV-Pyk2 shRNA注射显著减轻了急性HI脑损伤并改善了神经行为结局。在氧糖剥夺培养的皮质神经元中,抑制Pyk2可显著减轻NMDA受体介导的兴奋性毒性;在新生儿HI脑损伤中也观察到类似的结果。通过激光散斑对比成像证明了Pyk2抑制有助于长期脑血管恢复,但在Morris水迷宫和新物体识别测试中评估的认知功能没有明显改善。因此,慢病毒携带HIF-Pyk2 shRNA在缺氧环境中通过HIF-1α启动子介导对Pyk2的干扰。侧脑室注射LV-HIF-Pyk2 shRNA可显著改善HI治疗新生小鼠的长期认知功能恢复。以上结果表明Pyk2干扰对新生儿缺氧缺血性脑损伤具有保护作用,并且HIF-1α启动子介导的低氧条件调控是区分低氧期和正常期的有效方式。Pyk2有望成为治疗新生儿HI脑损伤的潜在药物靶点。
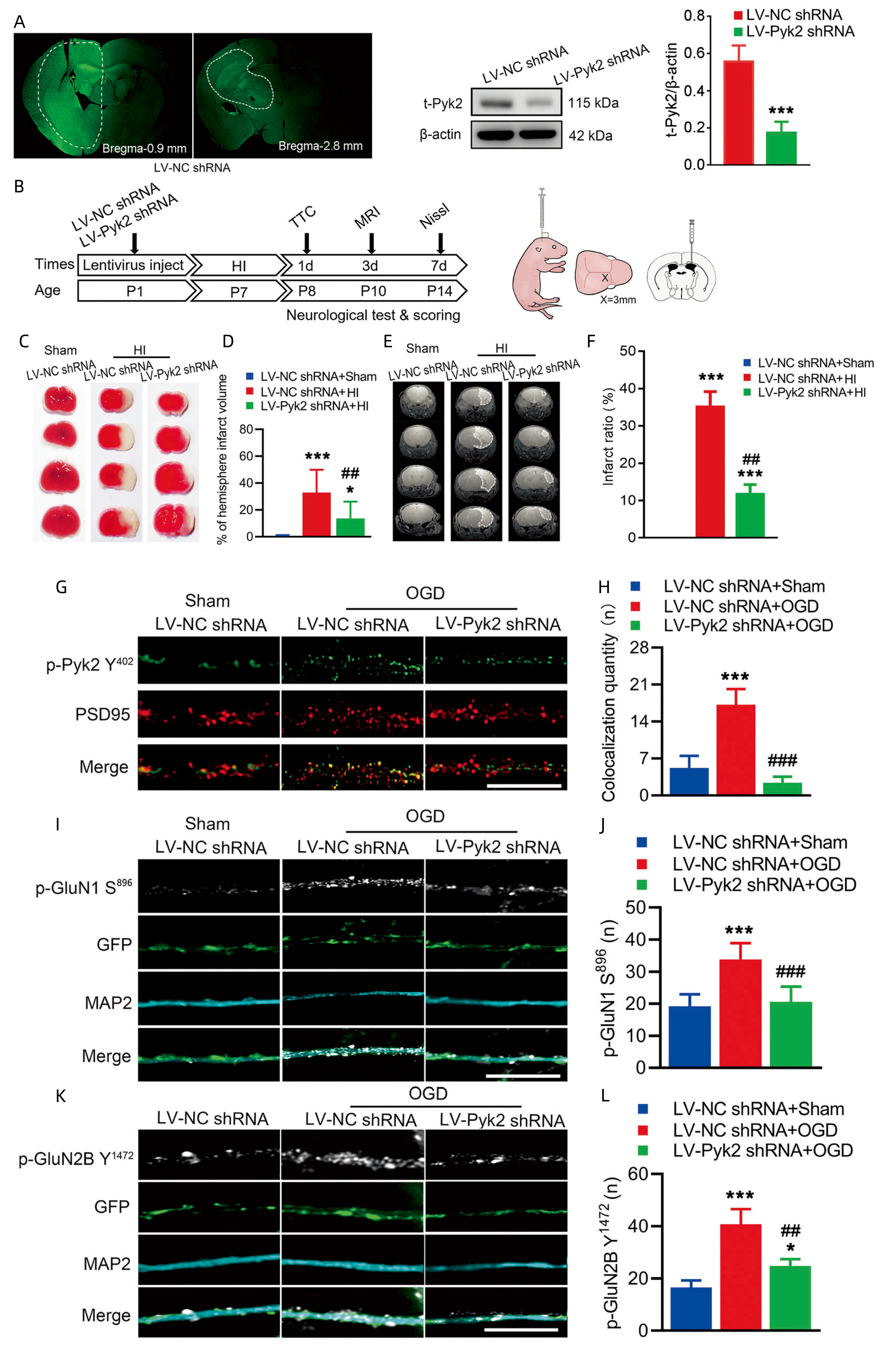
图5. 抑制Pyk2减轻新生儿HI后急性脑损伤以及减轻由NMDA受体介导的神经毒性损伤(PMID: 34226665)
文章标题:Nonoxid-HMGB1 Attenuates Cognitive Impairment After Traumatic Brain Injury in Rats
研究内容:创伤性脑损伤
发表期刊:Front Med (Lausanne) IF:5.058
作者及单位:广州中山大学附属第三医院神经外科 郭英
细胞类型:原代皮质神经元(产后1-3d新生大鼠)
病毒载体:pLKD-CMV-mcherry-2A-puro-U6-shSH3RF2/ pLKD-CMV-mcherry-2A-puro-U6
感染经验:MOI=20
创伤性脑损伤(TBI)成为全球主要的健康负担。高迁移率族蛋白b1 (HMGB1)是一种炎症介质可促进神经发生和轴突再生。SH3RF2是一种含E3连接酶SH3结构域的环指蛋白2,属于SH3RF蛋白家族。本文研究HMGB1的氧化还原状态在体外和体内神经突生长和再生中的作用。通过不同的重组HMGB1氧化还原异构体、RNA-seq测序分析预测潜在靶点、WB和IF检测SH3RF2蛋白的变化和分布、利用病毒载体进行调控基因表达、构建富含非氧化物hmgb1的外泌体用于治疗TBI大鼠、采用OF试验和NOR试验评价神经功能。结果表明,非氧化型HMGB1和fr-HMGB1(fully reduced HMGB1)促进轴突生长和延伸并使得神经元中的SH3RF2显著增加。SH3RF2的下调减弱非氧化型HMGB1的有利作用,HMGB1可通过SH3RF2改善大鼠TBI后的认知功能障碍。文章证明非氧化物HMGB1是通过上调SH3RF2的表达促进神经突生长和再生,非氧化型HMGB1是治疗TBI的潜在药物。
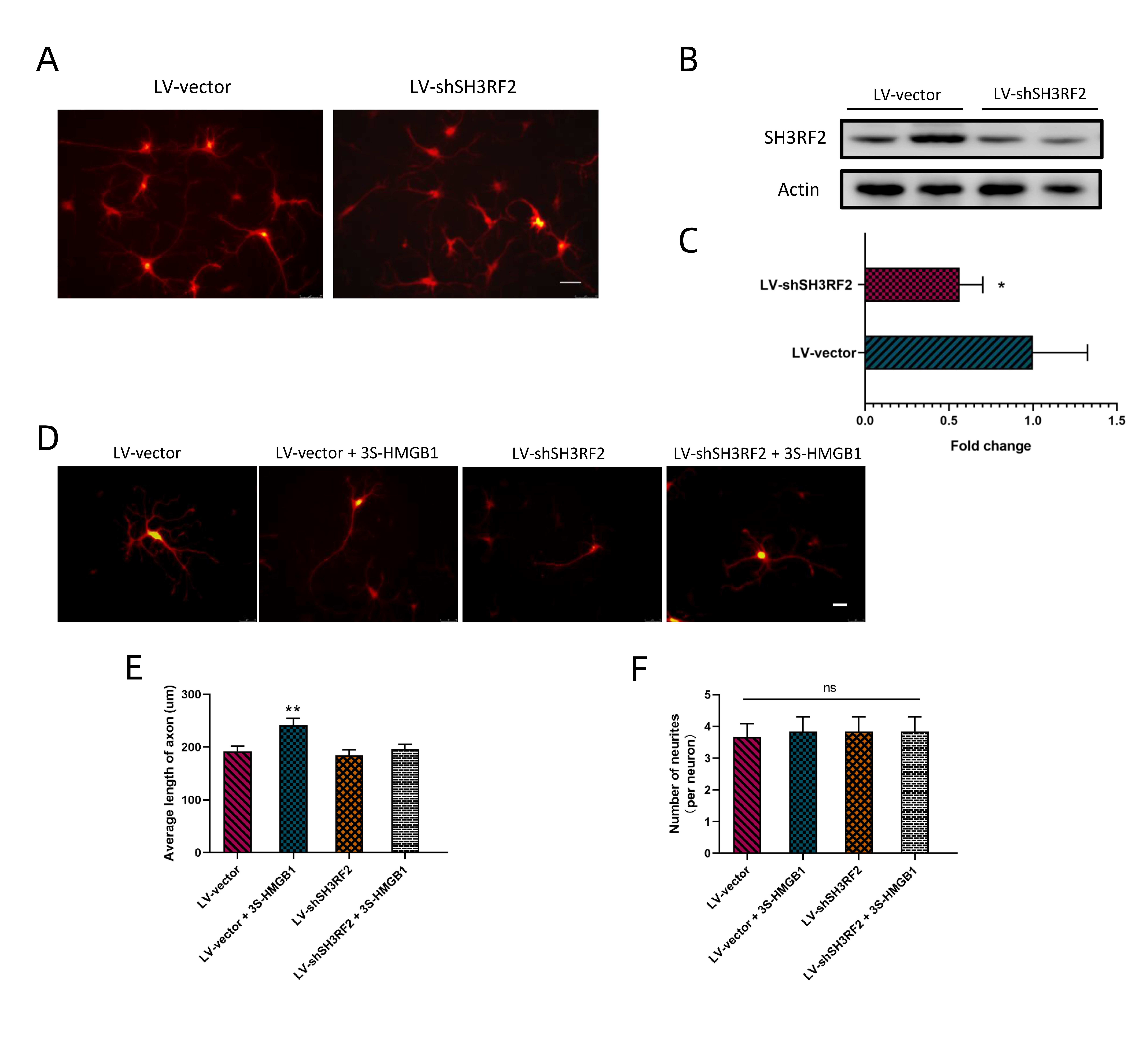
图6. 非氧化型HMGB1通过SH3RF2促进轴突生长(PMID: 35479959)
3、原代DRG神经元
文章标题:ZNF382 controls mouse neuropathic pain via silencer-based epigenetic inhibition of Cxcl13 in DRG neurons
研究内容:神经病理性疼痛
发表期刊:J Exp Med IF:17.579
作者及单位:浙江大学医学院第二附属医院 严敏
细胞类型:原代DRG神经元(3-4周龄C57BL/6J小鼠)
病毒载体:pLenti-MCS-EF1a-Cas9-FLAG-P2A-GFP(敲除)
神经损伤引起的背根神经节(dorsal root ganglion, DRG)基因表达的改变是神经病理性疼痛发生的关键。锌指蛋白382 (ZNF382)在神经损伤后的DRG神经元中表达下调,挽救这种下调可减轻伤害性超敏反应。相反,模拟这种下调可产生神经病理性疼痛症状,而敲低C-X-C基序趋化因子13 (CXCL13)或敲除其受体CXCR5可缓解这一症状。机制上,CXCL13启动子上游的顺式作用沉默子通过与ZNF382结合来抑制CXCL13的转录。阻断这一结合或从基因上删除这一沉默子可消除ZNF382对CXCL13转录的抑制作用,并损害ZNF382诱导的抗伤害性感受。此外,ZNF382的下调破坏了沉默-启动子环的抑制性表观遗传复合体,包括组蛋白去乙酰化酶1和SET结构域分叉1,从而导致CXCL13转录激活。因此,神经病理性疼痛需要ZNF382的下调,这可能是通过基于沉默的表观遗传去抑制DRG神经元中CXCL13,而CXCL13是神经病理性疼痛的关键参与者。
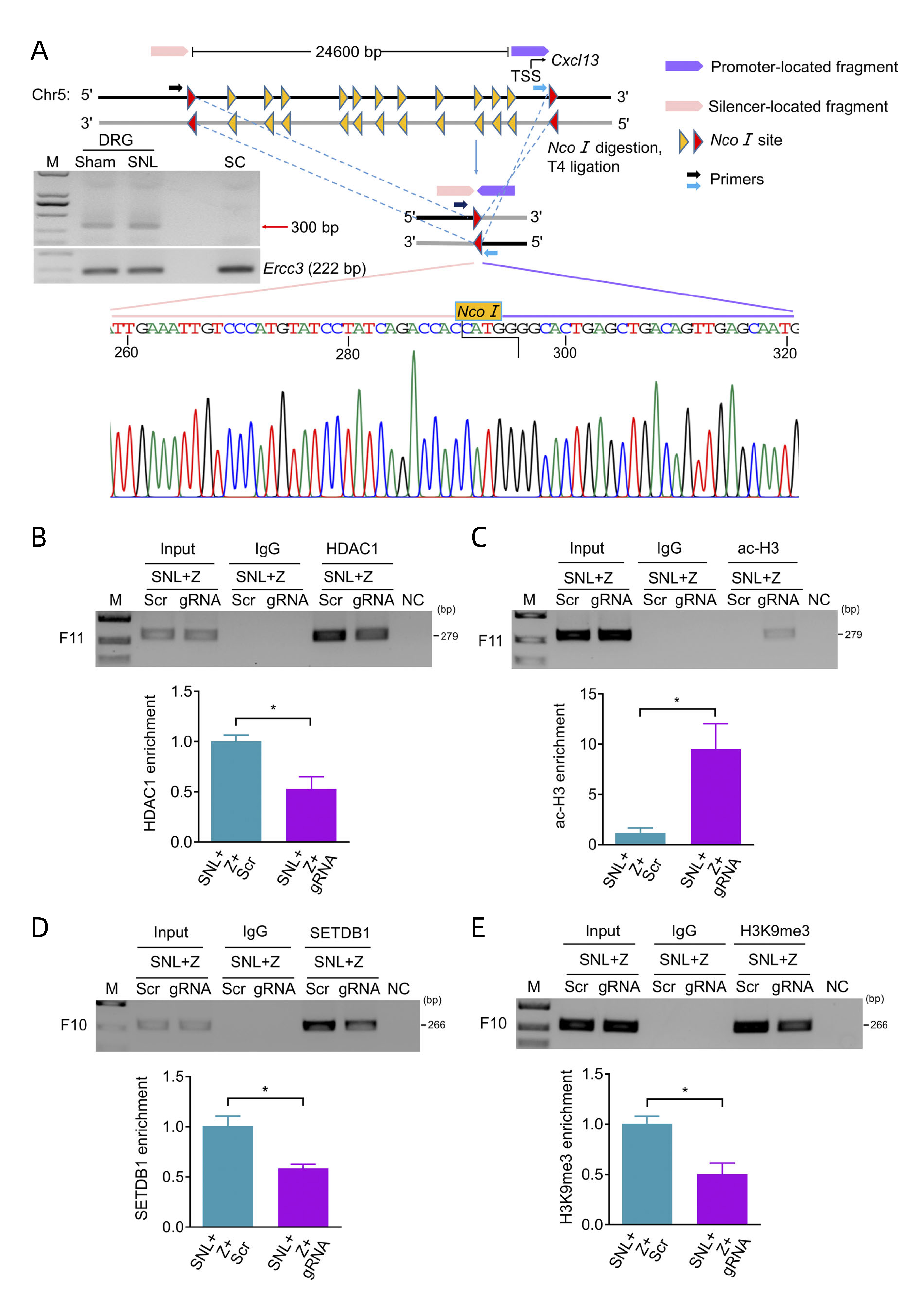
图7. ZNF382对CXCL13表观遗传修饰的调控需要沉默子(PMID: 34762123)
和元生物有幸提供以上文章中所涉及的病毒包装服务。
和元生物拥有三质粒/四质粒多种慢病毒包装系统。涵盖过表达/干扰、CRISPR/Cas9、Cumate诱导表达系统、Tet-on/off系统、Cre-loxp系统等专属您的定制慢病毒,同时也涵盖CRISPR/Cas9敲除或激活文库、自噬单标或双标、萤光素酶现货慢病毒产品。
和元生物自主研发获批专利的Vpack慢病毒包装系统,能够全面满足在科学研究中对基因调控的需求,解决病毒不出毒和滴度低的问题,能保证lncRNA表达更精确,载体荧光表达更亮,病毒出毒更稳定。
和元生物一直致力于病毒载体的研制服务,拥有10万+的病毒包装经验/4.6万+病毒载体库,包装GMP级别的病毒质粒。扫描下方二维码,获取更多应用细胞(细胞系、原代细胞、干细胞等)、类器官以及体内的基因调控(过表达、敲低、干扰等)经验。

扫一扫,反馈当前页面
和元生物