
新时代研究模型 | 类器官与慢病毒更配哦!
长期以来研究者都是利用动物模型进行疾病研究以及药物开发,而伴随生命科学的发展,为了获得更接近人体的生理环境及更相似的生理反应,科学家们尝试着复制和重建人类器官——终于,类器官诞生了。
近十年的时间,类器官一度成为CNS核心期刊的座上宾:
2013年,被《Science》杂志列入年度十大技术之一;
2015年,被《MIT Technology Review》杂志评为十大突破技术之一;
2018年,被《Nature Methods》杂志评为2017年度方法;
2019年,被《The New England Journal of Medicine》 杂志评为优良的临床前疾病模型。
类器官被广泛地应用于模拟人类疾病的研究,以迅猛的态势成为了研究热点。尤其是在肿瘤癌症模型中,类器官较其他模型有着很强的优势。尤其结合基因编辑技术,对揭示疾病发生发展的机制、快速评估肿瘤药物以及免疫细胞的治疗效果等方面意义重大。
如何对类器官进行基因编辑呢?小编精心整理了在不同疾病模型中,通过编辑类器官基因进行机制研究的案例,快来看看吧!!!
慢病毒在类器官中的应用
01 i-CRISPR: a personalized cancer therapy strategy through cutting cancer-specific mutations(肝癌)
IF:41.444 Q1 Molecular Cancer. 2022
样本来源:来源于不同的肝细胞癌类器官HCC-227/HCC-12
调控方式:LV-Cas9-gRNA(敲除)
实验结论:CRISPR切割3个位点联合2种DNA断裂修复抑制剂处理HCC-227能够显著抑制类器官的存活和平均数量。然而,特异性靶向HCC-227的gRNA切割位点对另一个类器官HCC-12没有影响。揭示利用DNA修复抑制剂对突变位点进行特异性基因编辑可显著抑制肿瘤生长。

图1 Cas9-gRNA联合DNA损伤修复抑制剂对HCC类器官的作用(PMID: 35974394)
02 Single-cell dissection of remodeled inflammatory ecosystem in primary and metastatic gallbladder carcinoma(胆囊癌)
IF:38.079 Q1 Cell Discovery. 2022
样本来源:患者术后的新鲜胆囊组织,构建两种不同的类器官GBO-819(MUC2−REG4−)和GBO-831(MUC2+REG4+),GBO-831代表肠化生类器官。
调控方式:LV-GFP/LV-KRASG12D-GFP(过表达)
实验结论:KRASG12D抑制剂能够显著抑制GBO-831-KRASG12D表现的胆囊上皮的恶性转化(核质比改变、核异型性及有丝分裂)如图2B,但并未导致GBO-819-KRASG12D的恶性转化,如图2A。揭示KRAS信号通路在肠化生性胆囊上皮的肿瘤发生中起关键作用。

图2 携带GFP/ KRASG12D的慢病毒转染胆囊类器官(PMID: 36198671)
03 Organoid modelling identifies that DACH1 functions as a tumour promoter in colorectal cancer by modulating BMP signalling(结直肠癌)
IF:11.205 Q1 EBioMedicine. 2020
样本来源:从人结肠隐窝,腺瘤和结直肠癌(CRC)样本中分离和培养类器官
调控方式:LV-Cas9-gRNA/LV-DACH1(敲除/过表达)
实验结论:DACH1的过表达增强了正常结肠隐窝/结直肠腺瘤类器官的球体形成、细胞增殖以及形成率,DACH1过表达的腺瘤类器官面积明显大于对照组。揭示DACH1具有促进干细胞特性的作用。

图3 DACH1促进正常结肠隐窝和结直肠腺瘤类器官的生长(PMID: 32512510)
04 Targeting the splicing factor NONO inhibits GBM progression through GPX1 intron retention(胶质母细胞瘤)
IF:11.600 Q1 Theranostics. 2022
样本来源:患者来源的GBM干细胞(P3)转染GFP后生成胶质瘤球体;培养18d大鼠胎脑类器官。将成熟的GBM-脑类器官共培养体外侵袭系统共培养72h后,进行共聚焦显微镜拍摄。
调控方式:LV-shNONO/LV-NONO-OE/LV-shNC/LV-NC(干扰/过表达)
实验结论:P3-shNONO的肿瘤球对大鼠脑类器官的侵袭能力降低,P3-NONO-OE的肿瘤球侵袭能力增强,对P3肿瘤球中NONO基因的调控可以显著影响其对大鼠脑类器官的侵袭能力。
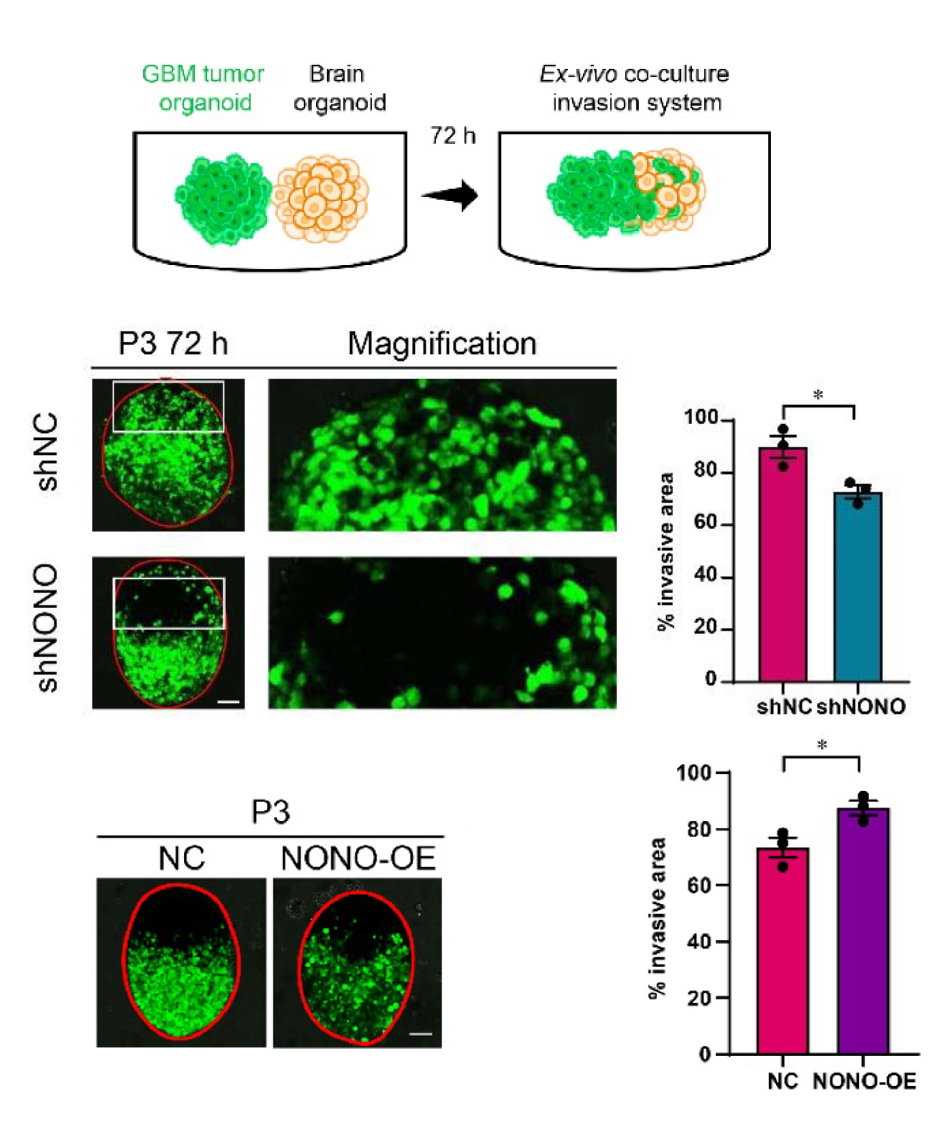
图4 GBM类器官体外共培养侵袭实验检测(PMID: 35910786)
05 Down-Regulation of Double C2 Domain Alpha Promotes the Formation of Hyperplastic Nerve Fibers in Aganglionic Segments of Hirschsprung’s Disease(神经球)
IF:6.208 Q1 International Journal of Molecular Sciences. 2022
样本来源:神经球从E13.5d C57BL/6小鼠结肠中分离并在37℃下培养。
调控方式:LV-shDOC2A(干扰)
感染经验:MOI为80
实验结论:DOC2A敲低表现为神经球中神经纤维的连接更加明显。

图5 不同神经球组间神经元极性的比较(PMID: 36142117)
和元生物有幸提供以上文章中涉及到的病毒包装服务
和元生物一直致力于病毒载体的研制服务,助力前沿科学研究。多年累积了丰富的病毒应用经验,包括对细胞系、原代细胞、干细胞、免疫细胞、类器官以及体内进行基因调控(过表达、干扰、敲除等)的应用经验。
和元生物自主研发获批专利的Vpack慢病毒包装系统,攻克了病毒不出毒和滴度低的问题,能保证lncRNA表达更精确,载体荧光表达更亮,病毒出毒更稳定,全面满足在科学研究中对基因调控的需求。
和元生物涵盖过表达/干扰、CRISPR/Cas9、Cumate诱导表达系统、Tet-on/off系统、Cre-loxp系统等专属您的定制慢病毒,同时也涵盖CRISPR/Cas9敲除或激活文库、自噬单标或双标、萤光素酶现货慢病毒产品。

扫一扫,反馈当前页面
和元生物