
硕果累累 | 复旦大学舒易来主任致力于遗传性耳聋基因治疗及临床转化
听力丧失是最常见的感官障碍之一,影响着很多人。根据世卫组织公布的《世界听力报告》,现有超15亿人患有不同程度的听力损失,到2050年,患听力损失的人数将近25亿。据统计,大约50%的先天性听力损失与遗传因素有关,目前临床上的治疗方案主要为佩戴助听器或植入人工耳蜗,但此类方法没有基于病因学从根本上治愈听力损伤。因此,治疗听力损失需要更好的替代疗法。随着基因治疗的蓬勃发展,基于病毒载体的基因疗法成为治疗遗传性听力损失的新热门赛道。
复旦大学附属眼耳鼻喉科医院舒易来主任长期致力于研究耳聋基因治疗及临床转化,在显性和隐性遗传性耳聋、后天性耳聋的防治上取得了诸多进展,为耳聋的治疗开辟了新方向。
2021年6月,复旦大学附属眼耳鼻喉科医院舒易来主任、李华伟教授与中国农业科学院(深圳)农业基因组研究所左二伟研究员等团队合作在Molecular Therapy上发表题为Gene editing in a Myo6 semi-dominant mouse model rescues auditory function的研究论文[1]。该研究以模拟显性感音神经性耳聋小鼠模型(Myo6WT/C442Y鼠)为对象,借助AAV-PHP.eB基因治疗递送载体,搭载CRISPR/Cas9基因编辑系统(AAV-PHP.eB-SaCas9-KKH-Myo6-g2),高效转染内耳毛细胞,实现了在体特异性敲除Myo6C442Y等位基因,并在长达5个月的时间内观察到了听觉功能的恢复。这也是国际上第一个利用CRISPR/Cas9技术针对Myo6基因突变导致的遗传性耳聋进行治疗,并获得成功的研究。为遗传性耳聋基因治疗临床转化提供了坚实的科学依据。
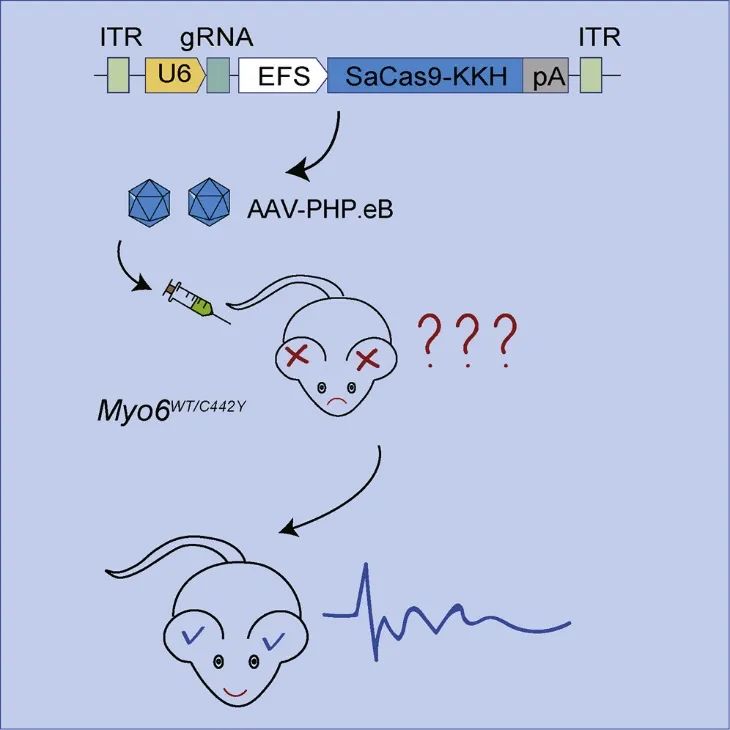
AAV-PHP.eB携带CRISPR/Cas9系统进行体内基因编辑(PMID: 34174443)
|
病毒产品 |
AAV-PHP.eB-SaCas9-KKH-Myo6-g2 |
|
实验动物 |
P0-2 Myo6WT/C442Y鼠 |
|
注射方式 |
RWM |
|
感染部位 |
内耳毛细胞 |
|
病毒用量 |
共0.5μL |
在遗传性耳聋中,隐性遗传占大多数。2022年2月,三位科学家又合作在Cell Research在线发表题为“Treatment of autosomal recessive hearing loss via in vivo CRISPR/Cas9-mediated optimized homology-directed repair in mice”的研究论文[2]。该研究以AAV-PHP.eB和AAV9双载体作为高效的基因治疗递送载体,转染Klhl18lowf鼠耳蜗内毛细胞,成功纠正了Klhl18基因C>A点突变,持久改善了听觉功能。首次实现基于CRISPR/Cas9-HMEJ技术治疗隐性遗传性感音神经性聋成功的研究,为遗传性耳聋的精准治疗以及临床转化提供了强有力的科学证据。(阅读原文:Cell Res | 舒易来/李华伟/左二伟团队开发CRISPR/Cas9-HMEJ系统取得遗传性聋基因治疗新突破)
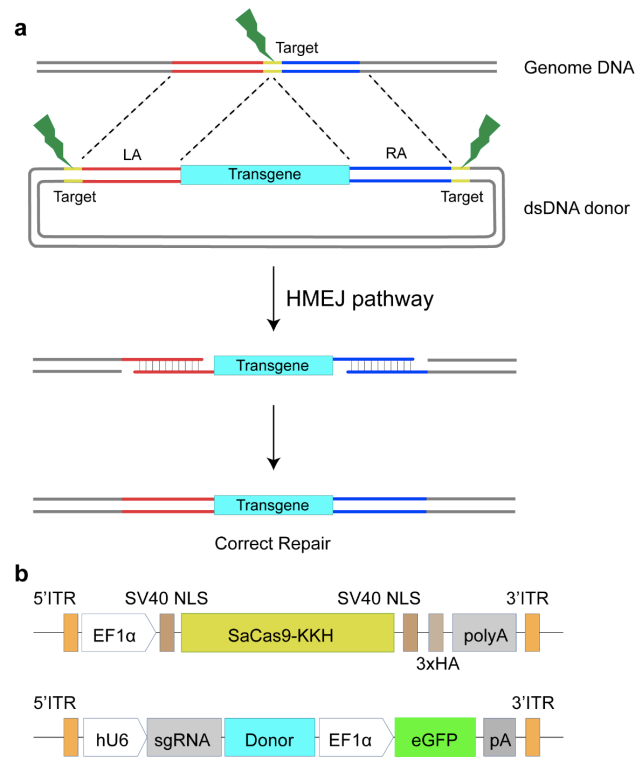
设计HMEJ同源重组治疗方案。a 针对筛选的sgRNA,设计HMEJ同源臂。b 基于AAV作为体内递送载体的双AAV治疗体系,其中一个AAV递送用于表达Cas9的载体,另外一个递送表达sgRNA以及携带同源臂的载体。(PMID: 35197607)
|
病毒产品 |
AAV9-SaCas9-KKH和AAV-PHP.eB-sgRNA-donor |
|
实验动物 |
P1 Klhl18lowf鼠 |
|
注射方式 |
RWM |
|
感染部位 |
耳蜗 |
|
病毒用量 |
共0.5μL |
基于RNA靶向CRISPR/CasRx系统具有特异性识别和编辑RNA的能力。同年3月,复旦大学舒易来主任、李耕林研究员与中国农业大学胡晓湘教授合作发现基于CRISPR/CasRx编辑系统在治疗常染色体显性遗传性听力损失中的作用。研究以高效的基因治疗递送载体--AAV-PHP.eB递送特异性靶向和编辑RNA的CRISPR/CasRx系统至Bth鼠内耳中,Bth鼠为Tmc1基因突变的显性耳聋小鼠模型,借助CRISPR/CasRx系统敲低Tmc1Bth等位基因的转录本,有效改善了毛细胞和静纤毛束的形态,防止了进行性听力损失。该研究成果发表在Signal Transduction and Targeted Therapy 期刊,标题为:Preventing autosomal-dominant hearing loss in Bth mice with CRISPR/CasRx-based RNA editing[3]。
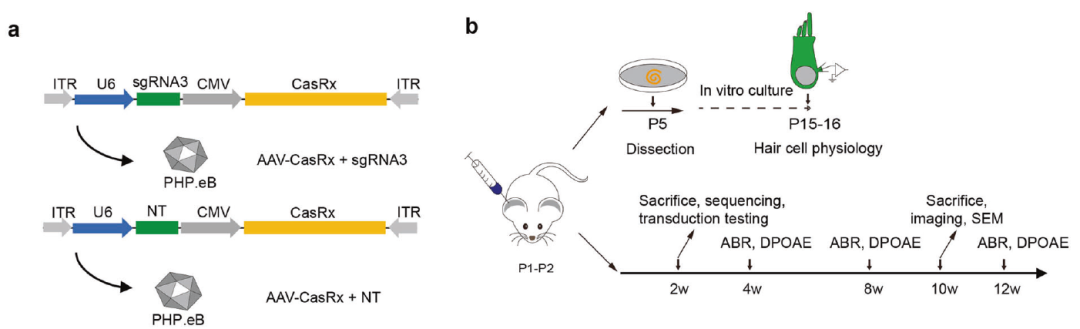
AAV- CRISPR/CasRx系统进行体内基因编辑方案(PMID: 35283480)
|
病毒产品 |
AAV-PHP.eB-CMV-CasRx-U6-sgRNA3 |
|
实验动物 |
P1-2 Bth鼠 |
|
注射方式 |
RWM |
|
感染部位 |
内耳毛细胞 |
|
病毒用量 |
~1.5μL(~5E+9vg) |
感音性耳聋有先天与后天之分,后天性耳聋是耳聋患者的重要部分,致聋原因主要包括耳毒性药物、噪音、老化、感染等因素,目前尚无可治疗的药物(突发性耳聋除外)。2022年4月,复旦大学附属眼耳鼻喉科医院舒易来主任、李华伟教授与陈兵教授团队借助CRISPR-CasRx的RNA编辑技术成功防治了耳毒性药物引起的后天性感音神经性耳聋。研究成果发表在Molecular Therapy-Nucleic Acids 杂志上,题为:Specific knockdown of Htra2 by CRISPR-CasRx prevents acquired sensorineural hearing loss in mice[4]。该研究基于前期研究成果,通过AAV- PHP.eB-RfCas13d-sgRNA3高效转染幼鼠内耳毛细胞,借助RfCas13d特异性靶向并高效切割RNA的特性,下调幼鼠内耳毛细胞中Htra2基因表达,显著提升了氨基糖甙类抗生素(aminoglycosides,AGs)暴露后小鼠耳蜗毛细胞的存活,并明显改善了后天性感音神经性耳聋小鼠的听觉功能。该研究创新性地以CRISPR-CasRx 基因编辑技术在小鼠模型中实现了高效敲降靶点RNA的目的,证明了CRISPR-CasRx系统在临床上防治后天性耳聋具有巨大的应用潜力。
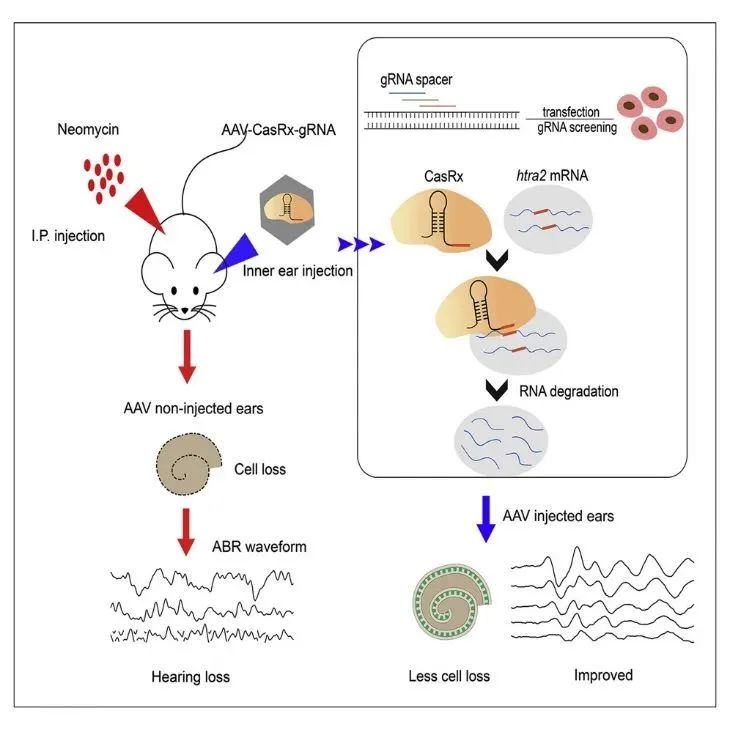
AAV-CRISPR-CasRx编辑系统改善了后天性感音神经性耳聋小鼠的听觉功能(PMID: 35615000)
|
病毒产品 |
AAV-PHP.eB-CMV-RfCas13d-U6-sgRNA3 |
|
实验动物 |
P1小鼠 |
|
注射方式 |
RWM |
|
感染部位 |
内耳毛细胞 |
|
病毒用量 |
0.5μL(~5E+9vg) |
2022年6月,舒易来团队创新性构建Atoh1-GFP小鼠以准确检测CRISPR/Cas9系统在内耳毛细胞中的编辑效率。并借助AAV-PHP.eB-SaCas9-KKH-g3高效转染Kcnq4+/G229D幼鼠内耳,显著改善小鼠的听觉功能。该研究为精准评估CRISPR/Cas9在体内的编辑效率提供了方向,促进了CRISPR基因编辑系统在疾病治疗中的应用。该研究发表在Molecular Therapy-Nucleic Acids 杂志上,题为:Precise detection of CRISPR-Cas9 editing in hair cells in the treatment of autosomal dominant hearing loss[5]。
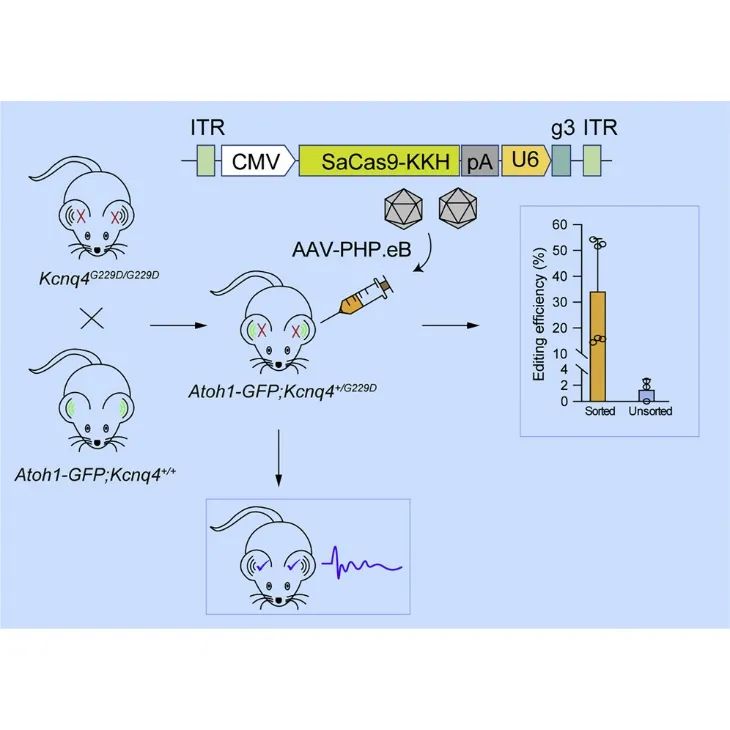
检测CRISPR/Cas9系统在内耳毛细胞中的编辑效率及AAV-PHP.eB-SaCas9-KKH-g3基因编辑(PMID: 36035752)
|
病毒产品 |
AAV-PHP.eB-SaCas9-KKH-g3 |
|
实验动物 |
P1-2 转基因鼠 |
|
注射方式 |
RWM |
|
感染部位 |
耳蜗 |
|
病毒用量 |
0.5μL |
和元生物有幸提供文章中所用的AAV病毒包装服务。
和元生物可提供多种AAV1-9、Anc80L65、AAV-PHP.eB和AAV2.7m8等几十种靶向耳科基因治疗的AAV血清型病毒包装服务;亦可提供特异性靶向内耳毛细胞(Hair Cells, HCs,包括内毛细胞, Inner hair cells, IHCs和外毛细胞, Outer hair cells, OHCs)、支持细胞(Supporting Cells, SCs)和螺旋神经节(Spiral Ganglion Neurons, SGNs)的多种特异性启动子。
此外和元生物已获得AAV-ie血清型的官方授权,得到专利持有者官方认证的AAV-ie系列产品将全力保障您的内耳听觉毛细胞基因递送之旅,欢迎咨询了解!
相关论文链接:
[1] https://doi.org/10.1016/j.ymthe.2021.06.015
[2] https://doi.org/10.1038/s41422-022-00624-y
[3] https://doi.org/10.1038/s41392-022-00893-4
[4] https://doi.org/10.1016/j.omtn.2022.04.014
[5] https://doi.org/10.1016/j.omtn.2022.07.016
业务咨询


扫一扫,反馈当前页面
和元生物