
Cell Reports|投射特异性研究揭示纹状体胆碱能神经元在帕金森中的作用
大家好,这里是只想咕咕的椰球。8月为大家带来的是一篇来自Cell Reports的研究。论文的标题很好地概括了这篇研究的主要内容,抑制胆碱能中间神经元增强直接通路中等多棘神经元的皮层-纹状体突触传输从而改善帕金森综合征动物的运动学习。本文的作者均来自法国的艾克斯-马赛大学。

在之前的解读文章中,我们已经介绍了细胞特异性(cell-type specific)研究在神经环路研究领域的基本思路和手段(具体内容可回顾往期文章:【Cell Reports】细胞特异性研究揭示前岛叶皮层VIP中间神经元在适应性行为中的作用)。通过遗传学等手段,细胞特异性研究可以针对性地关注某一群特征一致的神经元的活动规律和生理功能。而本文的研究者所关注的是纹状体中胆碱能中间神经元对直接通路中等多棘神经元这一特异性投射在帕金森病中所发挥的作用。因此可以认为本文的研究达到了“投射特异性”水平。
在本文中,作者在离体(脑片)和在体两个层面,利用光遗传学、化学遗传学操纵结合电生理、动物行为学等技术揭示了这条胆碱能投射通路对直接通路中等多棘神经元的突触传递和突触可塑性的调控作用,暗示胆碱能系统对纹状体神经元的调控可能依赖于多巴胺输入的整合。
引言
本文涉及了纹状体中两类不同神经元:胆碱能中间神经元和中等多棘神经元。作为基底神经节的重要输入结构,纹状体中占绝对主导地位的是一类名为“中等多棘神经元(medium spiny neurons,MSNs)”的GABA能神经元。MSNs广泛接受来自于皮层、丘脑的谷氨酸输入以及来自黑质的多巴胺输入,并与基底神经节的输出结构相连参与运动控制(图 1左)。MSNs可以被分为两类:膜表面表达Ⅰ型多巴胺受体的D1-MSNs直接投射向黑质网状部/内侧苍白球等基底神经节的输出结构,这条投射通路被称为直接通路(direct pathway),本文中研究的直接通路MSNs就是这类细胞;而表达Ⅱ型多巴胺受体的D2-MSNs则通过外侧苍白球、丘脑底核等核团与基底神经节的输出结构间接相连,因此被称为间接通路(indirect pathway)。多巴胺作用于D1-MSNs可以激活其活动但作用于D2-MSNs则会抑制间接通路的活动,直接通路和间接通路依赖于多巴胺调控的活动平衡被认为是基底神经节运动控制的重要基础(图 1中)。在帕金森病中,由于黑质中多巴胺神经元大量死亡,缺少多巴胺输入的两条通路活动逐渐失衡从而导致运动障碍的发生(图 1右)。

图1 基底神经节环路和帕金森病的经典模型(McGregor and Nelson,2019)
除了MSNs外,纹状体中还有少量的GABA能和胆碱能中间神经元。这两种中间神经元占比都不高(据估计只有1%-2%),它们主要投射向局部的MSNs并对MSNs的活动起到调控作用。在本文中,研究者关注的是纹状体中的胆碱能中间神经元(cholinergic interneurons,CINs),这类神经元因其以稳定的频率持续放电也被称为紧张性发放神经元(tonically active neurons,TANs)。以往的研究显示,当奖赏或者运动事件出现时CINs的紧张性发放会出现短暂的停顿,研究者普遍认为CINs可以通过这种方式改变纹状体中乙酰胆碱的浓度从而在运动学习或抉择中发挥调控作用。然而在帕金森病中,CINs却失去了通过暂停调控神经活动的能力。本文作者之前的研究发现,使用光遗传手段在帕金森模型小鼠中抑制CINs活动可以选择性地影响皮层经直接通路诱发的黑质神经元反应,这提示纹状体胆碱能神经元对直接通路MSNs的调控作用。然而,CINs向MSNs的胆碱能投射是如何影响皮层-纹状体信息处理通路的,在帕金森病过程中这种调节作用又会发生怎样的改变,依然值得进一步探索。
结果
为了在操纵纹状体CINs活动的同时对D1-MSNs进行记录,研究者首先建立了转基因工具鼠品系。利用Cre-loxp系统(关于Cre-loxp系统的应用可以参考文章:又见Cre!Cre/Loxp系统应用全攻略 | 知识点分享),研究者将ChAT-cre与Rosa-NpHR鼠杂交从而在胆碱能神经元中特异性表达抑制性光敏蛋白NpHR,然后再与D1-tdTomato鼠杂交从而使得D1-MSNs中特异性表达红色荧光。
在急性分离的纹状体脑片中,研究者使用全细胞膜片钳方式钳制表达了红色荧光的D1-MSNs,并在皮层施加电刺激以诱发MSNs产生突触后电位,同时使用585 nm光刺激以抑制CINs的活动(图 2A)。记录结果表明,在非帕金森鼠的脑片中,光刺激未能显著改变D1-MSNs的兴奋性突触后电位(excitatory post-synaptic potentials,EPSPs)和配对脉冲比(paired-pulse ratio,PPR)(图 2B)。然而,在单侧注射6-OHDA诱导帕金森模型的工具鼠所制备的脑片中,光刺激时记录到的诱发的EPSPs的幅度显著高于无光刺激,然而光照依然未使得PPR表现出显著变化(图 2C)。以上发现提示当纹状体失去多巴胺支配后,短暂抑制CINs活动可以增强直接通路MSNs中皮层-纹状体的突触传输。
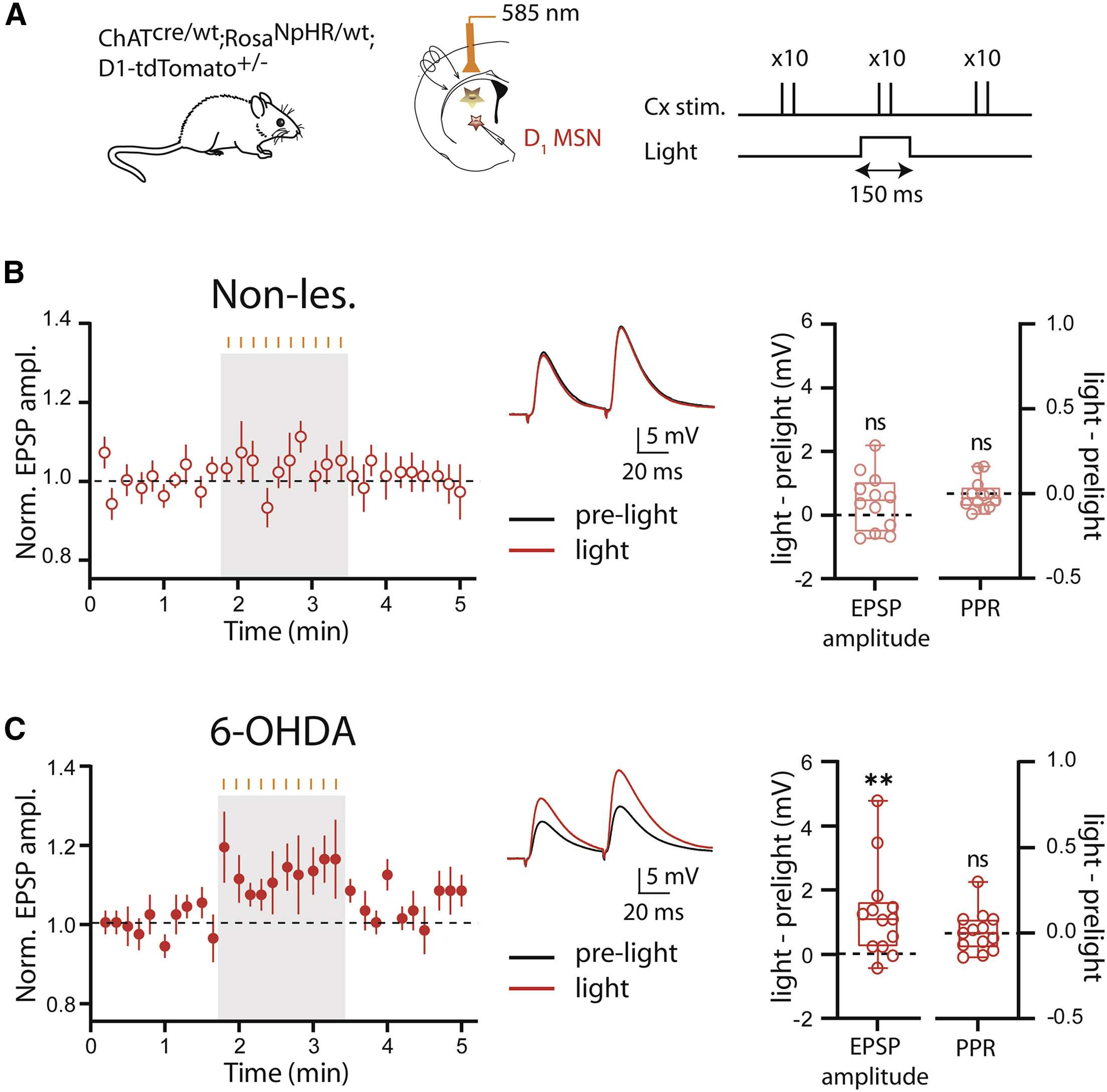
图2 6-OHDA模型动物中D1-MSNs皮层-纹状体EPSPs得到增强
光照导致EPSPs的幅度增强而PPR未发生改变提示了6-OHDA损伤可能对D1-MSNs突触后活动产生了影响。因此研究者接下来检测了特异性表达在D1-MSNs膜上的M4代谢型乙酰胆碱受体(M4 mAChRs)是否参与了胆碱能神经元对MSNs的调控。使用M4 mAChRs的抑制剂托吡卡胺(tropicamide)孵育脑片,研究者发现D1-MSNs中的诱发EPSPs出现了显著的上升(图 3A)。同样地,在托吡卡胺存在的条件下抑制CINs的活动并未对D1-MSNs的诱发EPSPs产生显著影响(图 3B),这提示M4 mAChRs可能参与CINs对皮层-纹状体突触传输的调控。
下一步,研究者想到由于M4 mAChRs是一种G蛋白偶联受体,激活Gαi偶联的M4 mAChRs将会抑制蛋白激酶A(PKA)的活动。因此PKA途径可能参与了胆碱能神经元对MSNs的突触后调控。为了验证这一假说,研究者将PKA的抑制剂(PKI)加载在电极内液中导入D1-MSNs。在电极内液中存在PKI的条件下,EPSPs幅度并未因光抑制CINs而出现上升(图 3C和3D),提示在帕金森模型鼠中,CINs通过M4 mAChRs及PKA途径调控皮层-纹状体的突触传输。
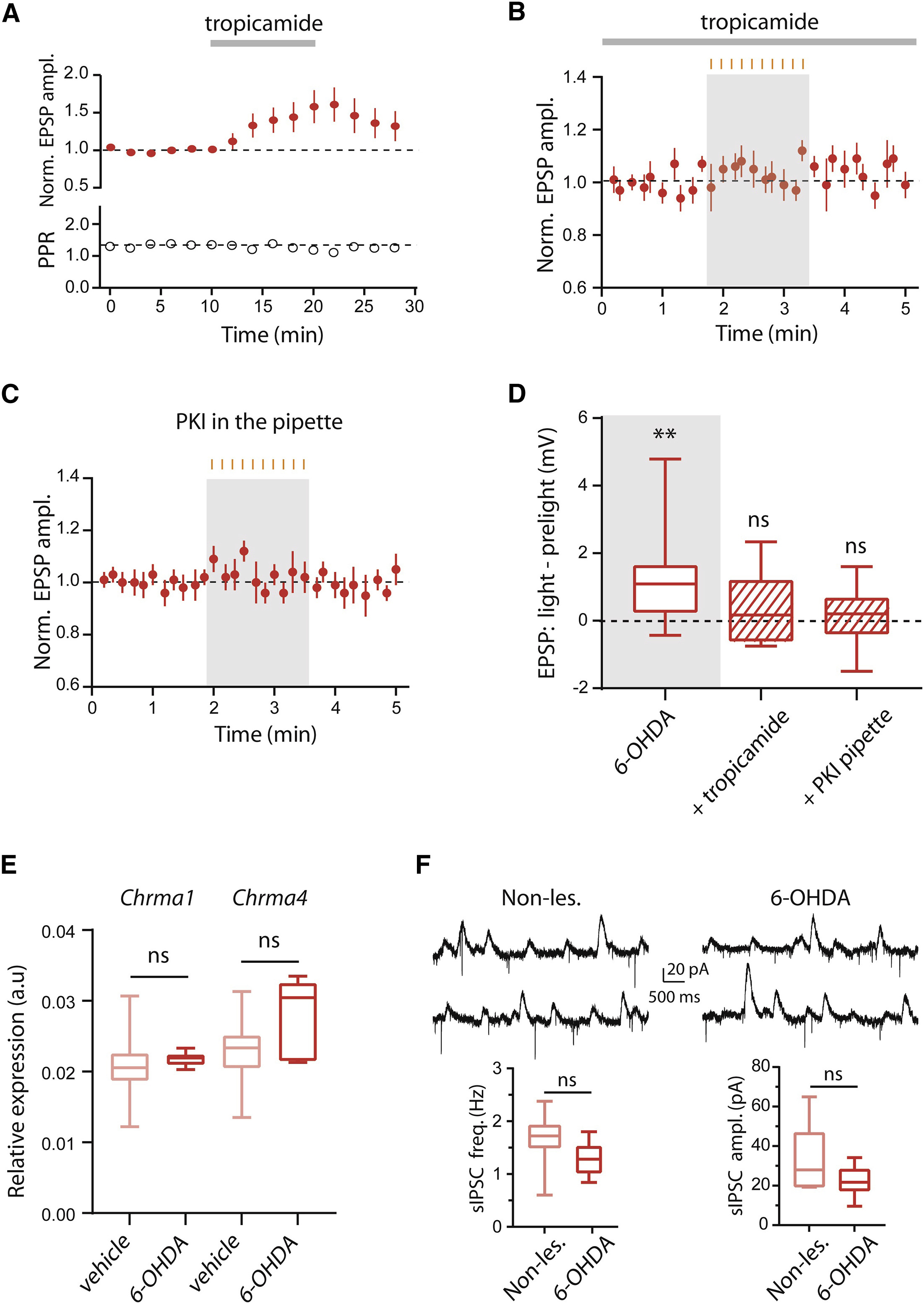
图3 在6-OHDA模型鼠中,M4 mAChR和PKA介导了D1-MSNs中光抑制CIN导致的皮层-纹状体EPSPs的上升
与此同时,研究者还提出了另外一个问题:为什么在6-OHDA模型鼠中,抑制CINs活动可以导致皮层-纹状体突出传输的改变,而在正常工具鼠中却检测不到这种改变?6-OHDA注射可以杀死黑质中的多巴胺能神经元,从而解除对MSNs和CINs的支配,这种改变是否影响了D1-MSNs膜表面M4 mAChR的表达量或者M4 mAChR对乙酰胆碱的亲和力?为了探索这个问题,作者分别使用流式荧光分选技术(FACS-sorting)和G蛋白激活的钾通道(GIRK2)对这两个问题进行了探索。结果显示6-OHDA模型鼠中的M4 mAChR的mRNA水平相比健康鼠虽然数值上略高于,但并没有统计上的区别(图 3E)。另外M4 mAChR对于内源乙酰胆碱的敏感性也未发生显著的变化(图 3F)。因此6-OHDA注射所导致的变化更有可能发生在CINs而不是MSNs上。
以上结果在脑片上证实了在帕金森模型鼠中光抑制CIN活动可以调控皮层-纹状体的突触传输。接下来研究者希望通过在体水平的实验进一步验证这一现象。首先研究者构建了一套在体诱导MSNs产生长时程增强(long-term potential, LTP)范式。依然采用上文提到过的转基因工具鼠模型,利用在体胞内记录手段,研究者对背侧纹状体(主要接受来自感觉运动皮层输入)细胞进行了记录。在膜电位的下降相,研究者对细胞注入去极化电流的同时使用短暂的高频电刺激以诱发LTP的产生(图 4A)。另外,研究者还检验了光刺激对CINs活动的抑制效果,结果表明光照可以强烈抑制纹状体CINs的放电,而在光照后CINs的活动出现了大幅度的反弹(图 4B)。
验证范式成立后,研究者分别检测了未损伤、6-OHDA模型和6-OHDA模型+CIN抑制三种情况下MSNs的LTP诱发情况。在未损伤状态下,高频电刺激后EPSP斜率随时间表现出明显的上升趋势,提示LTP被成功诱发(图 4C,灰色)。而在6-OHDA帕金森模型动物中,EPSP斜率完全不随时间变化,表明在帕金森模型动物中皮层-纹状体的突触可塑性遭到破坏(图 4C,绿色)。最后,在6-OHDA模型动物中使用光抑制CIN活动使得EPSP斜率出现了小幅上升,虽然不及未损伤动物的程度,但是显著高于无光刺激的模型动物(图 4C,黄色)。以上结果表明,光抑制CINs活动可以部分恢复帕金森动物中的LTP作用。
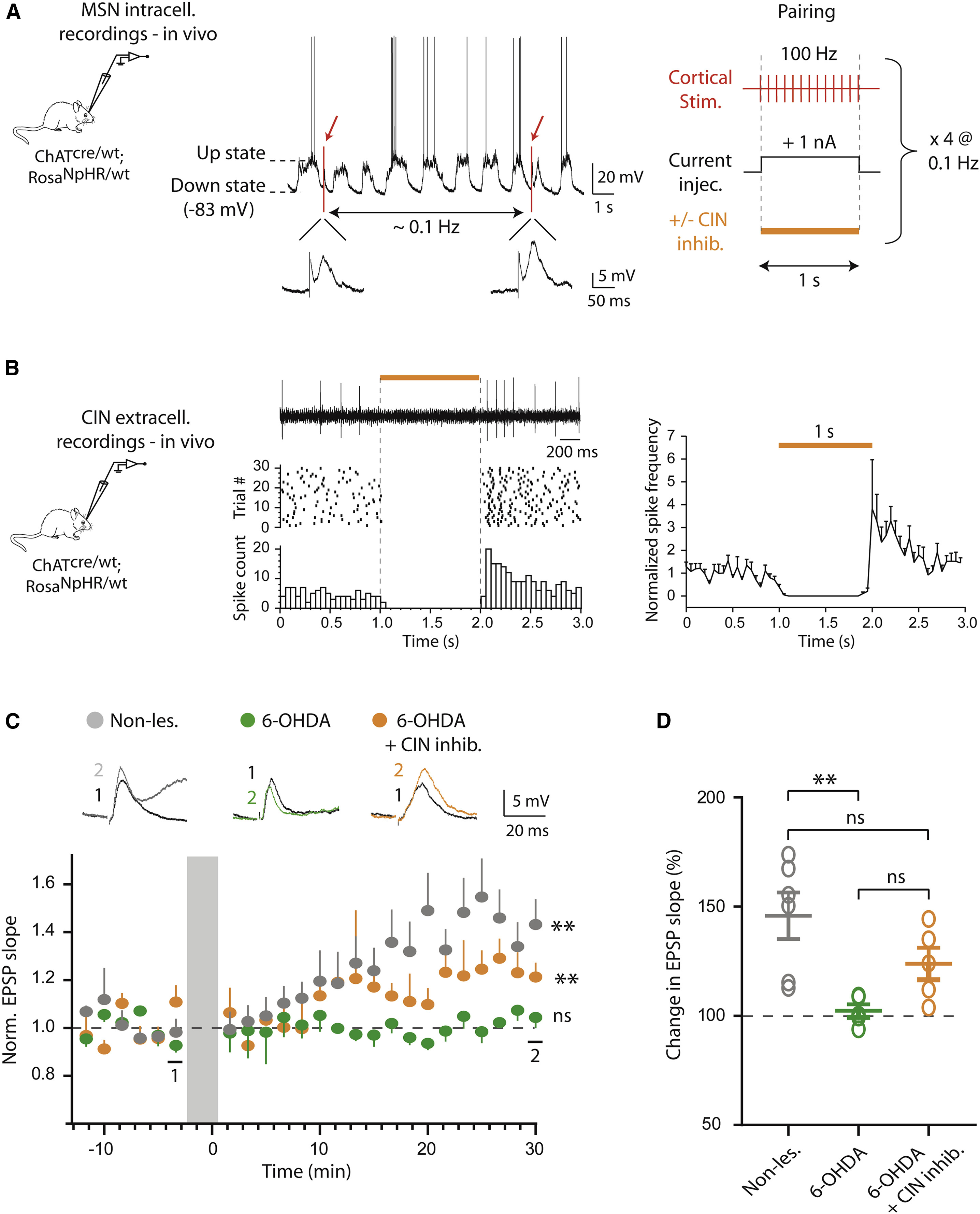
图4 在帕金森模型鼠中光抑制CIN活动可以部分恢复皮层-纹状体的在体长时程增强作用
在本文的最后,研究者检验了抑制纹状体CINs活动对动物行为表型的改变。作为一个高水平的研究,从细胞层面过度到行为层面从而形成研究层次的完整是必需的。为了检验抑制CIN对动物运动能力的影响,研究者使用加速转棒(Rota-Rod)实验作为运动技巧学习的范式,并且采用化学遗传的方式对CINs的活动进行了操纵。首先研究者还是在电生理水平验证了化学遗传抑制的效果。在ChAT-cre鼠的纹状体注射cre依赖的受体hM4Di(巧合的是hM4Di正是从乙酰胆碱受体上改造而来),给予CNO后研究者发现CINs的放电频率出现了显著的下降,并且可以维持30 min以上(图 5B)。接下来,作者分别在6-OHDA模型动物的纹状体注射携带了hM4Di或空载的AAV病毒,未损伤的sham动物也在纹状体注射了含空载体的AAV病毒作为对照(图 5C)。研究者对这三组动物进行了转棒实验的训练和测试,结果不出意外,注射了对照病毒的6-OHDA模型动物从转棒上跌落的速度最快,表现出最短的掉棒潜伏期(latency to fall)。而未损伤动物则表现出最长的掉棒潜伏期,虽然只有150 s(图5D,灰色)。而在转棒测试前给予CNO化学遗传抑制CINs活动使得动物的掉棒潜伏期显著高于6-OHDA模型鼠(图5D,黄色)。以上结果表明抑制CINs活动可以改善帕金森模型鼠的运动学习能力,这与上文电生理记录的结果是一致的。
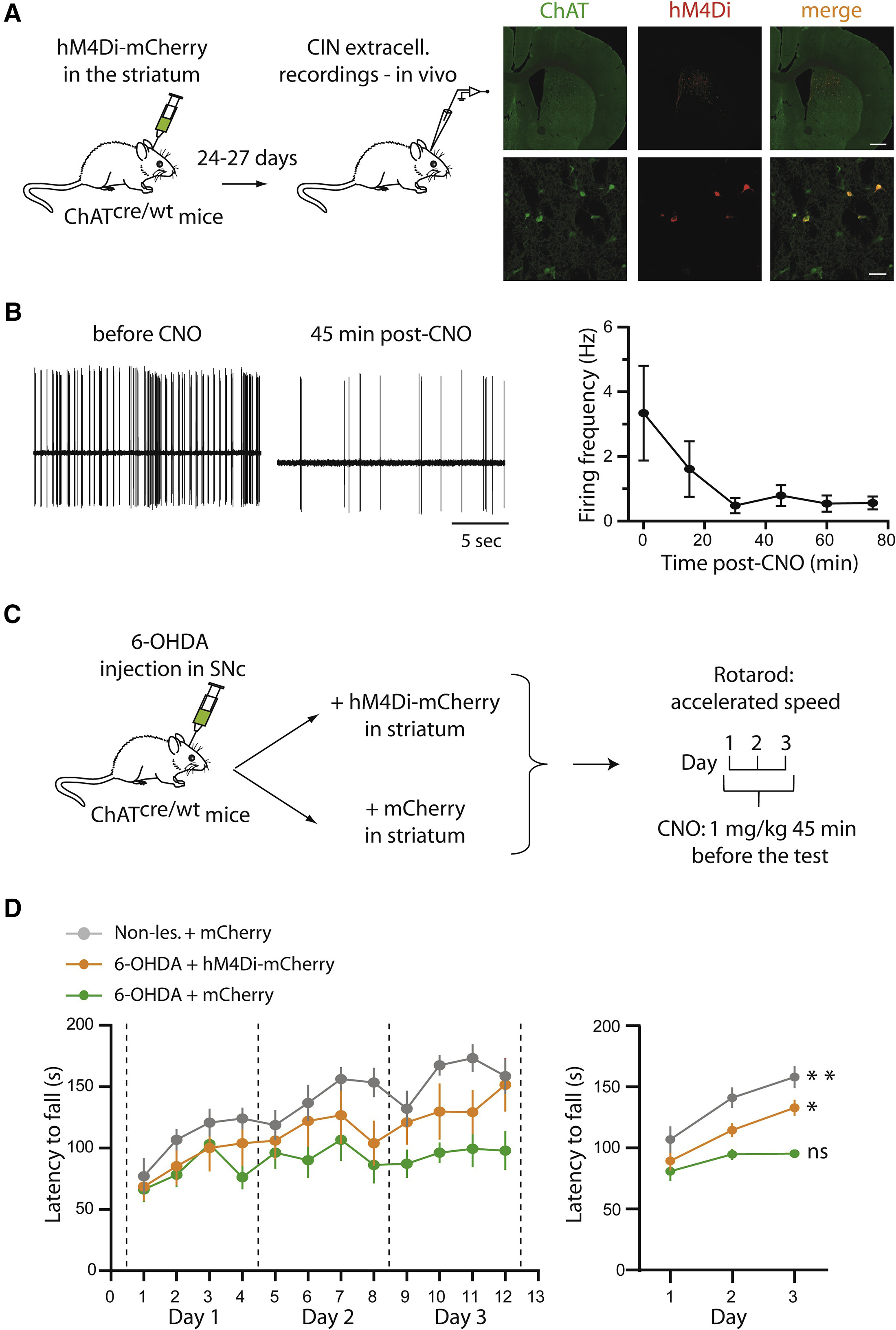
图5 在6-OHDA诱导的帕金森模型动物中使用化学遗传抑制CINs活动可以增强动物的运动技巧学习能力
尾声
本文虽然篇幅不长(只有四个figure),但是基本遵循了我们之前所提到的环路研究思路(由于是投射特异性研究,本文不需要示踪实验,但是记录和操纵实验贯穿始终),内容扎实,从细胞到行为水平一应俱全。尤其是研究者在脑片和在体研究中所采用的范式难度不小,体现出了研究者高超的电生理功底。当然不可否认的是,作者在主要研究内容中依然未能解答6-OHDA损伤是如何改变纹状体CINs-MSNs环路从而导致调控模式产生变化的这一问题。虽然我们可以推测这一改变与多巴胺系统的缺失有着千丝万缕的联系,但是其具体路径依然非常值得关注。
[1] McGregor M M, Nelson A B. Circuit mechanisms of Parkinson’s disease[J]. Neuron, 2019, 101(6): 1042-1056.

扫一扫,反馈当前页面
和元生物