
基因治疗在美国:细数美国基因治疗试验的资助和基金情况
2020年3月,JAMA刊登了“Sponsorship and Funding for Gene Therapy Trials in the United States”的分析文章,文章统计了美国对基因治疗领域研究和临床试验所提供的基金和资助。为给基因治疗从业者提供更多全球视角,和元生物 特总结该文主要内容,以飨读者。

自2017年以来,美国食品和药物管理局(FDA)陆续批准了4种基因疗法上市:针对癌症的Kymriah和Yescarta,针对遗传性视网膜疾病的Luxturna,以及针对脊髓性肌肉萎缩的Zolgensma。尽管这些基因疗法在临床治疗上具有变革性,但其单次治疗的标价分别为475000美元、373000美元、425000美元和210万美元。高昂的开发成本和激励创新的需要是此类高昂价格的常见理由。

然而,容易被忽略的是,公共资金在每个基因治疗产品的发明和临床试验中都扮演了重要的角色。未来,随着越来越多的基因疗法出现,关于美国国家卫生研究院(NIH)、学术界和工业界在药物开发中的相关作用的探讨将会继续。为了给这个讨论提供数据,本文量化了美国基因治疗试验的赞助和资金来源。

本文的数据截至2019年8月29日,作者根据FDA对基因治疗的定义,在ClinicalTrials.gov搜索了如下术语相关的数据:治疗学和遗传学治疗试验: gene therapy(ies), genetic therapy(ies), gene transfer(s), genetic transfer(s), viral vector(s), transduce(d), genetic engineering。
作者收集了临床试验的治疗手段、分期情况、治疗情况、参与者、赞助者和资助者。赞助商取最主要位置的唯一值、资助者定义为作为赞助者或合作者的任何实体,包括任何提供资金或支持的实体。为了关注近期进展的美国基因治疗临床试验,作者排除了2019年1月前结束的临床试验,排除被终止的、退出或暂停状态的试验;排除发生在美国以外的临床试验。
在统计到的826个临床试验中, 341个符合数据统计分析入选标准。在纳入的试验中,130例(38%)是体内基因治疗(其中107例的目的为修正基因缺陷),221例(65%)是肿瘤治疗疗法(见表1)。
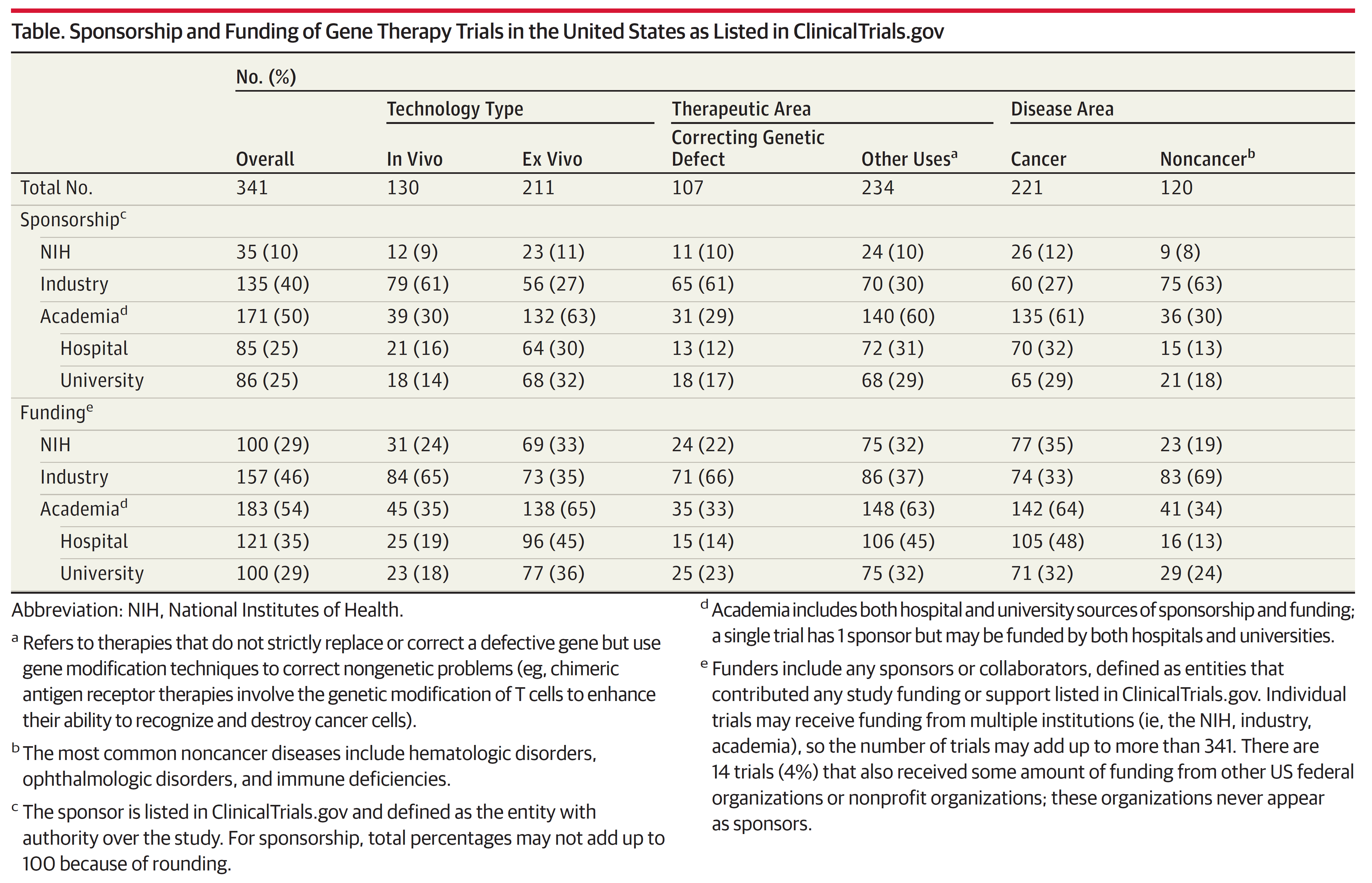
从统计中可以看到,在赞助(sponsorship)的项目中,35项临床试验由美国国家卫生研究院(NIH)赞助 (10%),135项临床试验由药企赞助(40%),85项临床试验由医院赞助(25%),86 项临床试验由大学赞助(25%)。在基金资助(funding)的项目中,NIH 提供了29%的项目基金,制药企业提供了46%的项目基金,学术界(医院和大学)提供了54%的项目基金(有重叠代表双重基金)。36%的基因治疗项目由药企单独资助,50%的项目由学术界或NIH单独资助。
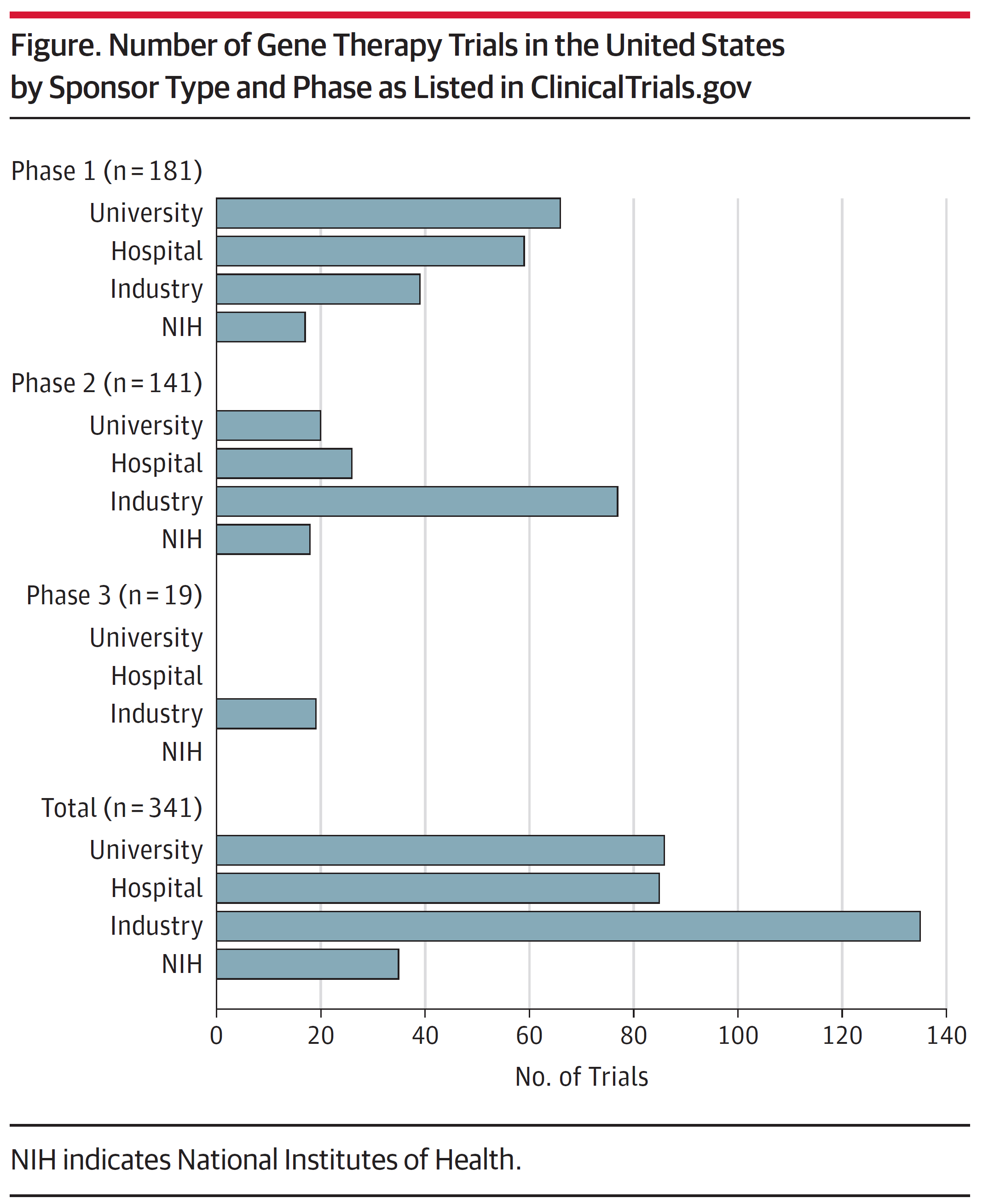
如果根据临床试验的类型和阶段来分,制药企业赞助了61%的体内基因治疗试验,61%的治疗试验都是用来纠正基因缺陷,63%的试验与癌症无关;27%的试验采用体外基因治疗手段,30%的治疗试验非基因缺陷相关,27%的试验针对癌症。药企赞助了22%的I期临床试验,55%的II期临床试验和全部III期临床试验(图1)。

从上述ClinicalTrials.gov检索的结果,我们可以看到,2019年1月开始,药企资助或赞助(funding and sponsorship)的比例少于半数(46%),单独资助的比例仅有36%,这代表NIH为代表的研究机构正在加大力度推动基因治疗临床试验。药企赞助了所有的III期临床试验,而学术机构赞助了几乎一半II期临床试验,这些II期试验可以作为FDA基因疗法快速审批通道的最后测试,也代表学术机构和NIH在基因治疗领域中,除了支持基础科学研究,还在扮演越来越重要的角色。
作为一家新型基因和细胞治疗产业化CDMO服务公司,和元生物 可提供非注册临床研究用质粒和病毒生产、基因治疗新药临床申报整体方案、基因治疗临床样品及商业化GMP生产等服务,涉及产品包括基因和细胞治疗用质粒、慢病毒、腺相关病毒、溶瘤病毒、新型基因疫苗等,同时欢迎基于外泌体的药物开发合作。
以“基因药·中国造”为使命,助力基因治疗造福人类的伟大愿景。


扫一扫,反馈当前页面
和元生物