
【NAT CELL BIOL】:新发现!m6A调节AKT信号促进子宫内膜癌的致瘤性
最近各种宫廷攻略刷屏,今天出出戏,来了解一款 “网红”m6A。人们很早就发现mRNA存在着腺嘌呤上的甲基化修饰(m6A)。越来越多的证据表明高等生物mRNA和lncRNA上普遍存在m6A修饰,近来发现mirRNA、cirRNA及rRNA都存在这种修饰。
N6-甲基腺嘌呤(N6-methyl-adenosine(m6A))是高等生物中含量最为丰富的一种RNA甲基化形式,平均每一条mRNA含有3-5个,存在于保守序列RRACH(R=G ,A; H=A,C or U)的腺嘌呤上。其功能由“编码器”(Writer)、“读码器”(Reader)及“消码器”(Eraser)协同起作用。编码器(Writer)即甲基转移酶METTL3、METTL14等,消码器(Eraser)可逆转甲基化有FTO、ALKBH等,m6A由m6A结合蛋白(读码器(Reader))识别,目前发现的有YTH等结构域蛋白。
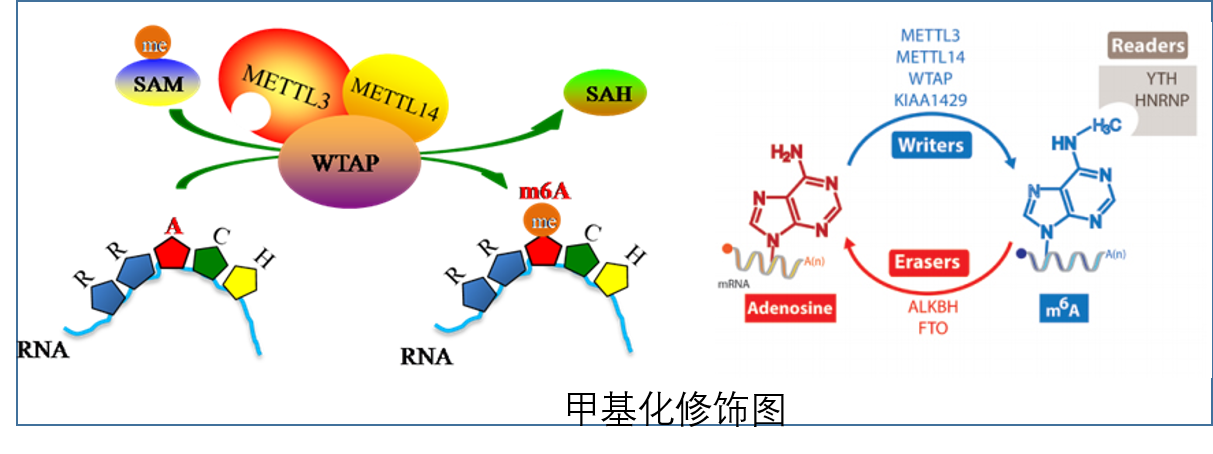
这种修饰是可逆的,通过甲基转移酶METTL3、METTL14,去甲基转移酶FTO和ALKBH5调控其生物学特性。m6A修饰在基因表达调控中起着重要作用,如转录水平上调控RNA稳定性、运输、剪切等1。研究表明m6A mRNA甲基化影响干细胞和癌细胞的生长和增殖2-4。然而,m6A甲基化如何影响细胞生长以及哪些潜在途径和机制调节这些变化仍未得到充分阐明。
近日来自霍华德-休斯医学研究所和芝加哥大学的Chuan He和Ernst Lengyel在《自然细胞生物学》上发表了最新的研究成果。低水平的m6A mRNA甲基化通过影响AKT信号通路促进子宫内膜癌细胞的增殖和致瘤性。

结果
1.低水平m6A mRNA甲基化与子宫内膜癌的发生密切相关
研究发现肿瘤组织中m6A转移酶复合体核心亚基METTL14的298位点频繁突变,导致甲基转移酶功能失活,抑制mRNA总的m6A甲基化水平。相对于正常组织,70%的肿瘤(包括METTL14野生型)都出现总m6A mRNA甲基化水平下降。(Fig. 1a-e)。RT-qPCR检测发现与相邻的正常组织相比,癌组织中m6A甲基转移酶METTL3的表达显著下降(Fig. 1f)。METTL3的表达与肿瘤组织中m6A mRNA甲基化水平正相关。免疫组化在蛋白水平上得到一致的结果(Fig. 1g)。同时研究人员发现肿瘤组织中METTL14突变与METTL3的表达减少是不共存的,METTL14突变METTL3的表达就是正常的。癌症基因组图谱TCGA数据分析显示两者没有明显的相关性。结果表明大部分的子宫内膜癌都表现出由于METTL14突变或METTL3的表达减少而导致的低水平的m6A mRNA甲基化。
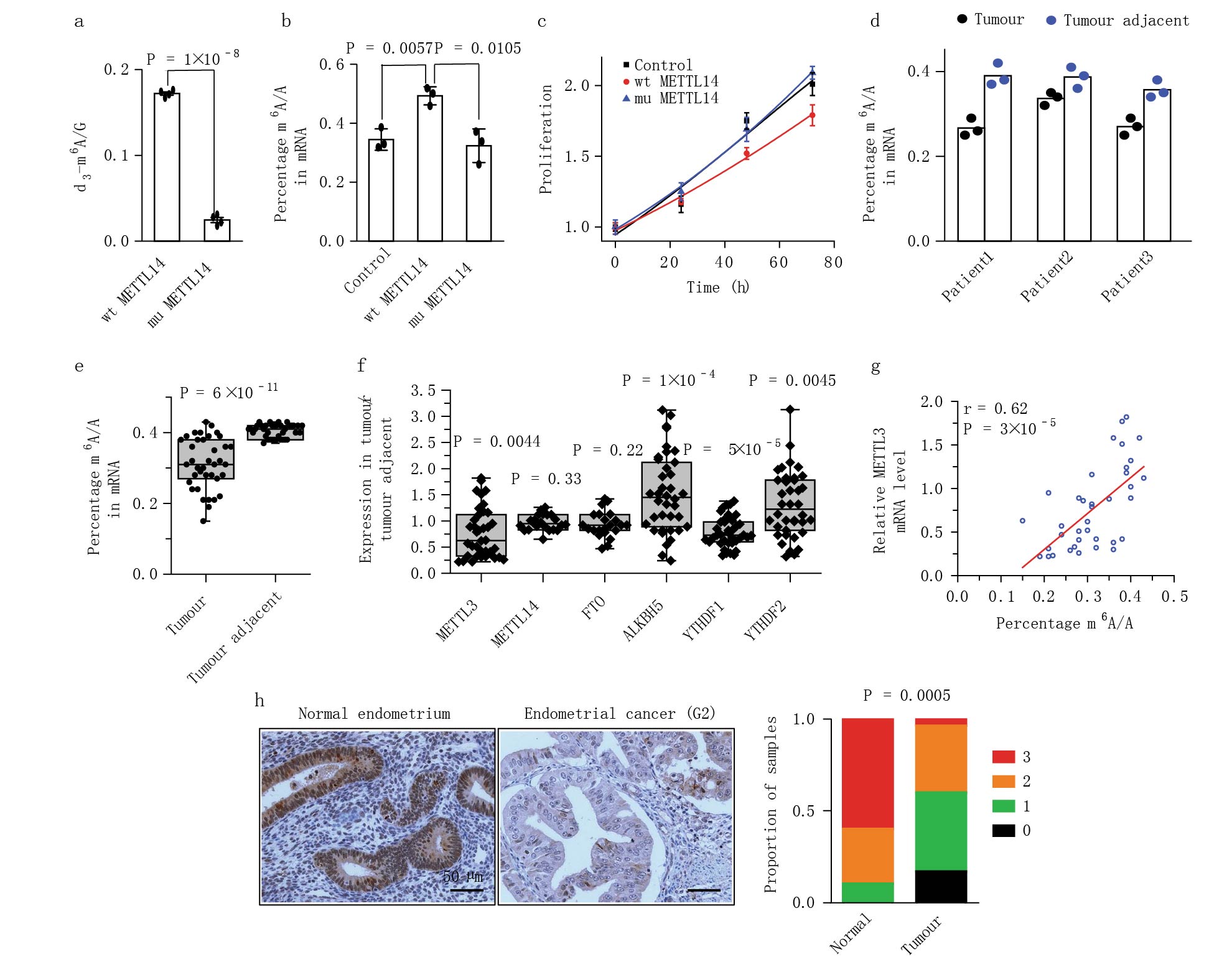
图1 METTL14突变及METTL3表达下降减少子宫内膜癌患者的m6A mRNA甲基化水平
2.异常m6A甲基化促进子宫内膜癌细胞的增殖
m6A甲基化的水平与细胞生物学特性相关,尤其是对关键转录因子甲基化的影响。为了研究METTL14功能缺失对肿瘤细胞系的影响。研究人员用CRISPR技术敲除HEC-1-A(子宫内膜癌细胞系)中METTL14。蛋白质印迹和测序分析可知敲除细胞系都是杂合敲除。METTL14 /–敲除细胞系中m6A甲基化水平下降和肿瘤样本中观察到的结果一致(Fig. 2a)。同时发现促进细胞的增殖、克隆形成、细胞迁移和浸润(Fig. 2b-e)。病毒介导的RNA干扰敲低HEC-1-A细胞系中METTL3的表达与METTL14 /–得到的结果一致(Fig. 2f-j)。
为了验证体外细胞系观察到的表型,作者进一步研究了体内METTL14 /–和METTL3对肿瘤发生的影响。将野生型HEC-1-A细胞系和METTL14 /–敲除HEC-1-A细胞系分别注射到裸鼠的腹腔膜,2-3周后观察肿瘤的大小和数量。注射METTL14 /–敲除细胞的小鼠成瘤更大转移数量更多(Fig. 2k)。在注射野生型和突变METTL14上(Fig. 2l)以及敲低METTL3和对照细胞的裸鼠上观察到相似的趋势(Fig. 2m)。
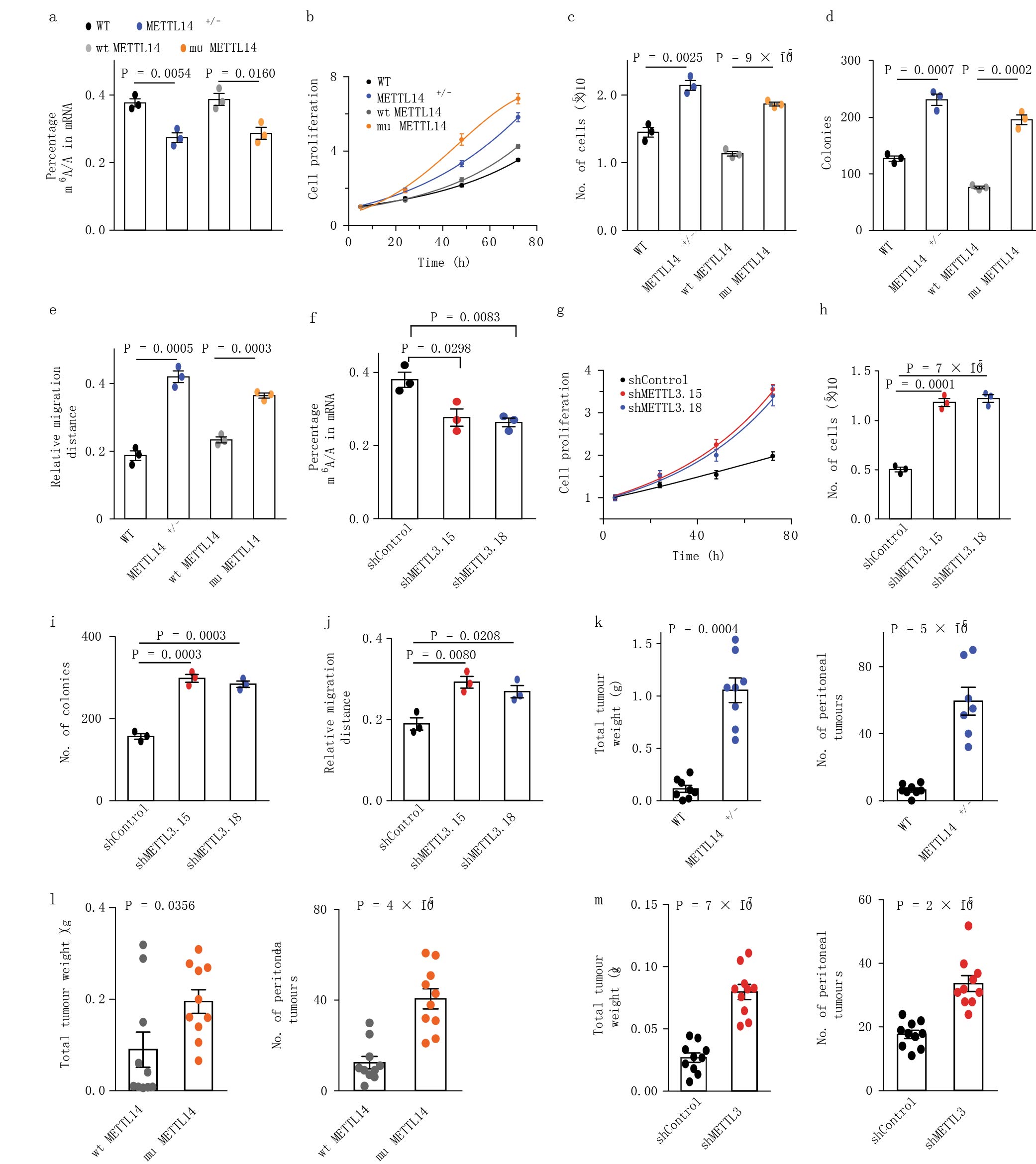
图2 低水平m6A甲基化促进细胞的增殖、迁移以及活体内肿瘤的生长
3.m6A-seq检测出子宫内膜肿瘤中甲基化改变的转录
研究人员对来源于病人肿瘤组织和相邻正常组织做了m6A-seq检测分析,发现m6A峰值在肿瘤组织中只有正常组织的一半(Fig. 3a)。m6A甲基化减少的转录本主要富集在与细胞迁移、增殖、生长、粘附和细胞死亡相关的基因本体(GO)位置。在敲低METTL3 和METTL14突变的的HEC-1-A细胞系也得到一致的结果。
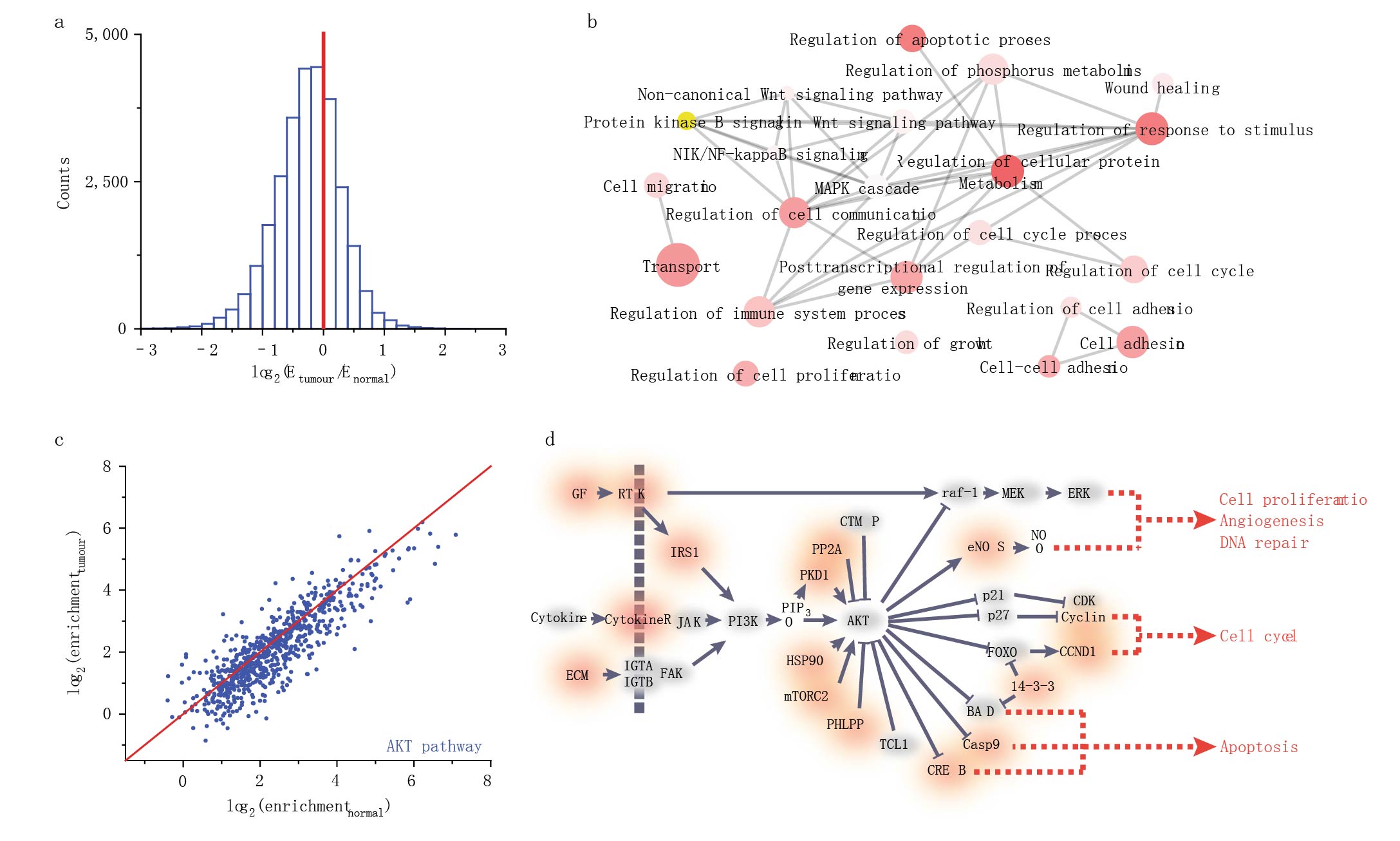
图3 肿瘤组织m6A甲基化水平下降
4.m6A甲基化调控AKT信号通路的激活
AKT信号通路促进细胞的存活和生长,在子宫内膜癌和其他癌症通过致癌突变激活。研究发现与正常邻近组织相比,肿瘤中参与AKT途径的许多基因显示出m6A甲基化减少(Fig. 3c,d)。研究发现METTL14功能缺失的hec-1-a细胞系与对照相比,AKT丝氨酸(S473)磷酸化水平显著提高(Fig. 4a)。苏氨酸和总AKT蛋白表达水平没有改变。AKT磷酸化的这些变化刺激AKT信号,导致AKT下游效应因子的磷酸化的增加(Fig. 4b)。说明低水平的m6A甲基化通过磷酸化激活AKT信号通路。
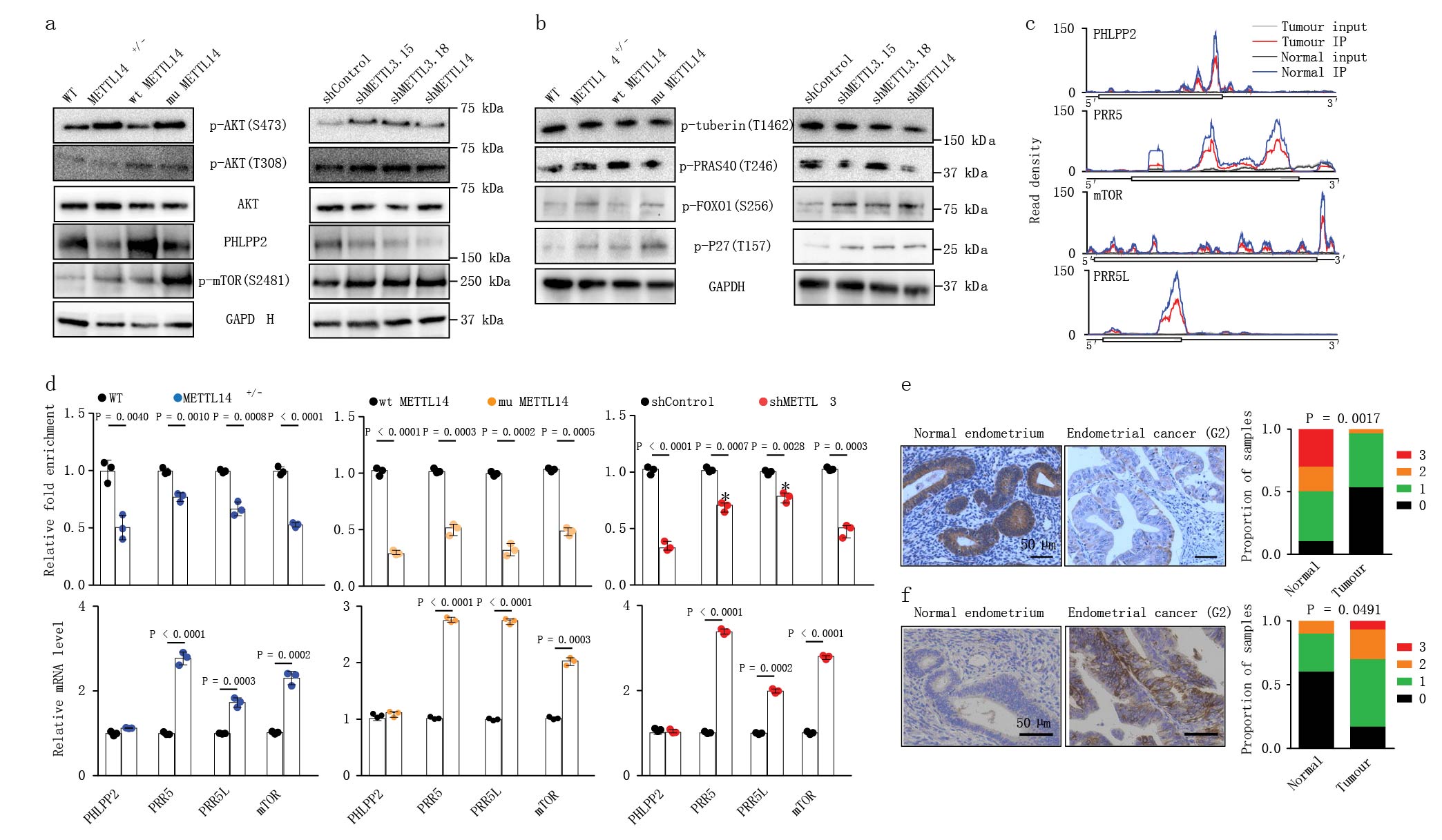
图4 减少的m6A甲基化激活AKT
5.m6A甲基化控制AKT激活调控因子的表达
进一步研究PHLPP2(编码蛋白磷酸酶,AKT去磷酸化失活)和mTORC2(一种磷酸化AKT的激酶)来确定低水平m6A甲基化作用下AKT激活的机制。编码PHLPP2和mTORC2复合体(PRR5、PRR5L和mTOR)的转录本在患者样本中也显示m6A甲基化的减少(Fig. 4c)。在这些细胞系中,观察到PHLPP2蛋白的表达减少,而其mRNA水平没有明显改变;相反,p-mTOR(mTORC2的标记)除了蛋白质水平增加,PRR5、PRR5L和mTOR的mRNA表达也增加(Fig. 4a,d)。免疫组化结果PHLPP2在肿瘤组织中确实下降(Fig. 4e,f)。
接下来研究m6A甲基化如何调控PHLPP2和mTORC2的表达。病毒介导在HEC-1-A细胞系中敲低YTHDF1(阅读蛋白的一种促进m6A的转录和翻译)的确减少了PHLPP2的表达(Fig. 5a)。PHLPP2表达的这些变化不是由于PHLPP2转录本数量变化,而是由于激活PHLPP2转录核糖体的变化(Fig. 5a,c)。而PRR5、PRR5L和mTOR的转录本是受YTHDF2(介导mRNA转录本降解)的影响(Fig. 5d,e)。干扰结果证实减少的m6A甲基化减弱YTHDF1对PHLPP2(AKT负调控调)促翻译,减少YTHDF2对mTORC2(AKT正调控)转录本的降解。
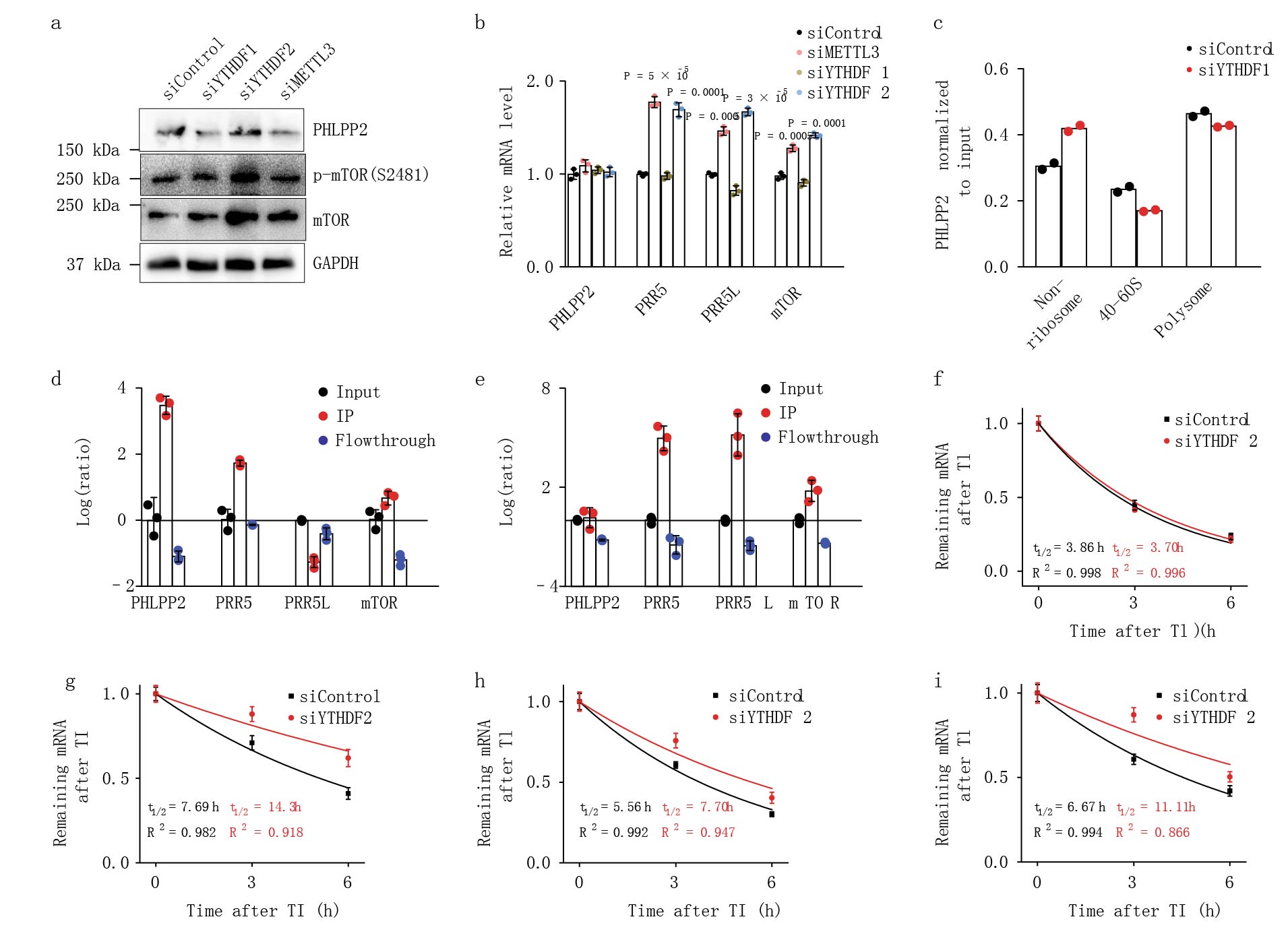
图5 m6A结合蛋白调控AKT通路相关基因表达
6.低m6A甲基化增加AKT信号促进细胞增殖
进一步研究证明子宫内膜癌细胞中减少的甲基化通过激活AKT来促进增殖。过表达PHLPP2和抑制mTORC2(敲低mTORC2的关键基因RICTOR)都减少了AKT磷酸化的水平,从而减缓了由于敲低METTL3,突变METTL14和METTL14 /-等引起子宫内膜癌细胞系HEC-1-A的增殖(Fig. 6)。

图6 低水平m6A调控AKT信号影响细胞增殖
N6-甲基腺苷(m6A)mRNA甲基化是一种影响癌症进程中细胞分化和增殖的基因调控机制。通过TCGA数据分析、甲基化水平检测、基于病毒载体在细胞和动物模型上进行基因表达水平操作(敲除、RNA干扰和过表达),证实低水平m6A甲基化通过激活AKT信号途径导致子宫内膜癌细胞增殖和致瘤性。m6A可能是肿瘤治疗的一个潜在的靶点。
参考文献
1.Liu, N. et al. N6-methyladenosine-dependent RNA structural switches regulate RNA–protein interactions. Nature 518, 560–564 (2015).
2.Geula, S. et al. Stem cells. m6A mRNA methylation facilitates resolution of naïve pluripotency toward differentiation. Science 347, 1002–1006 (2015).
3.Batista, P. J. et al. m6A RNA modification controls cell fate transition in mammalian embryonic stem cells. Cell Stem Cell 15, 707–719 (2014).
4.Zhao, B. S. et al. m6A-dependent maternal mRNA clearance facilitates zebrafish maternal-to-zygotic transition. Nature 542, 475–478 (2017).

扫一扫,反馈当前页面
和元生物