
Nat Commun | 厉害了!用T细胞杀死“T细胞”,还不会误伤友军
前言
2022年7月,上海交通大学杨选明团队在Nature Communications发表“T cell receptor β-chain-targeting chimeric antigen receptor T cells against T cell malignancies”,该研究利用T细胞恶性肿瘤中T细胞受体(T cell receptor, TCR)β链可变区的特异性,设计和构建嵌合抗原受体(chimeric antigen receptor, CAR),通过一系列体外和体内实验证明这一CAR-T细胞治疗策略的安全性和有效性。
背景介绍
T细胞恶性肿瘤尽管在化疗下缓解率较高,但许多患者肿瘤仍然会复发,而T细胞恶性肿瘤发病机制错综复杂,小分子靶向的治疗方法难以开发,因此临床急需新的治疗策略。CAR-T细胞在B细胞来源的白血病中显示出良好的治疗效果,但用它治疗T细胞恶性肿瘤依然面临诸多困难。例如CAR-T细胞的制备过程中混有肿瘤细胞,以及CAR-T细胞自相杀伤,或杀伤正常T细胞。为避免这些问题,需要选择肿瘤细胞特异表达的抗原。
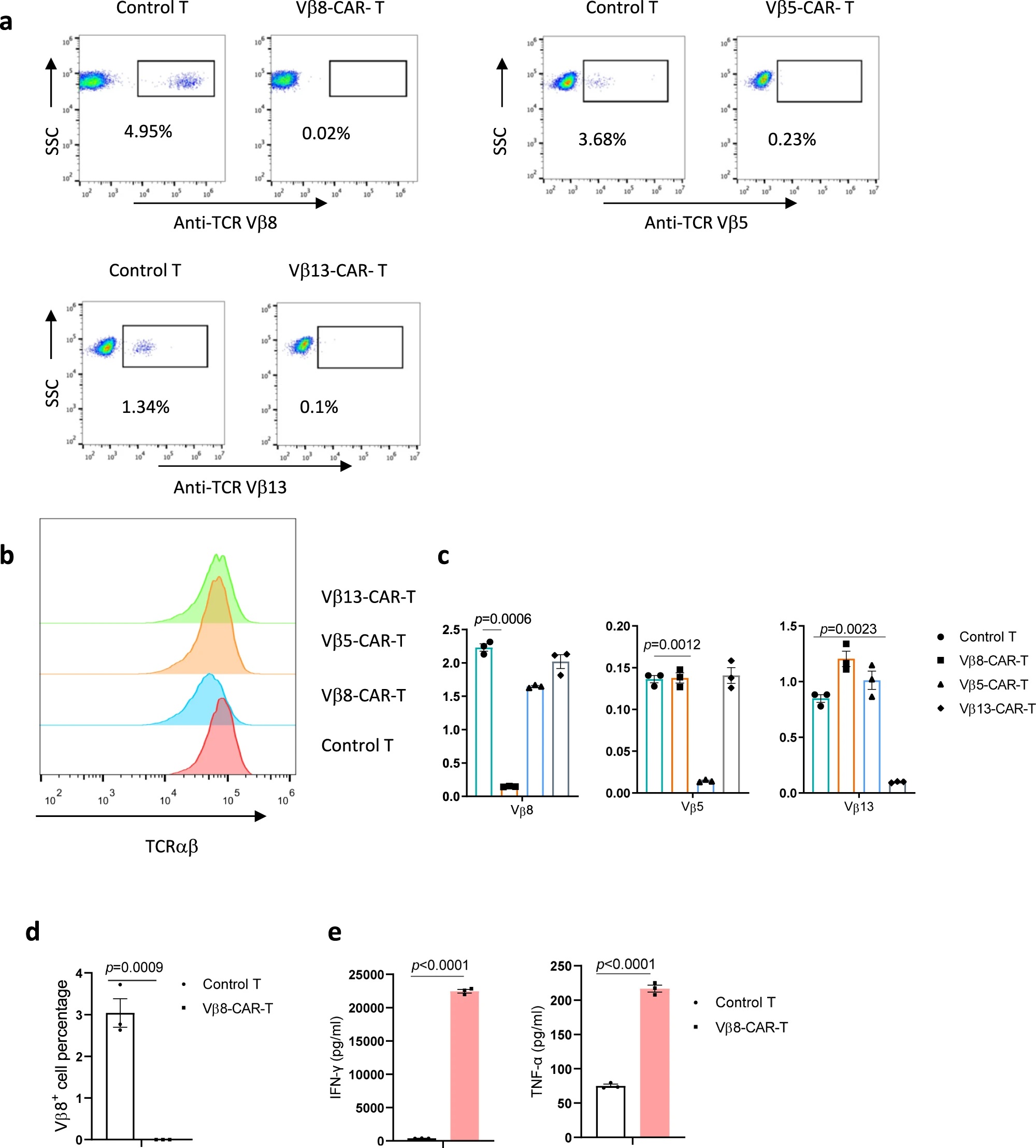
在T细胞发育过程中,TCR多样性来源于α链或β链可变-多样-连接区结构域(variable-diversity-joining-domain, VDJ-domain)的基因重排。TCR β链可变区的编码基因包含52个Vβ片段,1个D片段和13个J片段,同时在人体中Vβ基因片段有24个家族,每个T细胞克隆三个区各仅选择1个片段进行组合,因此,正常TCR库中单个特定TCR Vβ亚型的出现频率大约在0.58-10.84%。而发展为T细胞恶性肿瘤的T细胞克隆较为单一,通常只有1个特定的TCR Vβ及Vα亚型。作者利用这一特异性区分肿瘤细胞和正常T细胞,并应用于CAR-T细胞设计。
研究思路
01 针对特定的Vβ亚型设计CAR-T细胞,检测CAR-T细胞自身靶点表达,并通过与正常T细胞,以及Vβ8-和Vβ8+配对细胞系共培养,检测Vβ8-CAR-T细胞的杀伤表型。
02 在长期持续抗原刺激下检测Vβ8-CAR-T细胞增殖、维持和杀伤能力。
03 在免疫缺陷小鼠模型中验证Vβ8-CAR-T细胞的抗肿瘤效果。
04 对靶向Vβ5的CAR-T细胞杀伤表型进行重复验证,拓宽策略适用范围。
05 检测特定亚型Vβ的T细胞缺失后对适应性免疫的影响,验证CAR-T治疗策略安全性。
研究内容
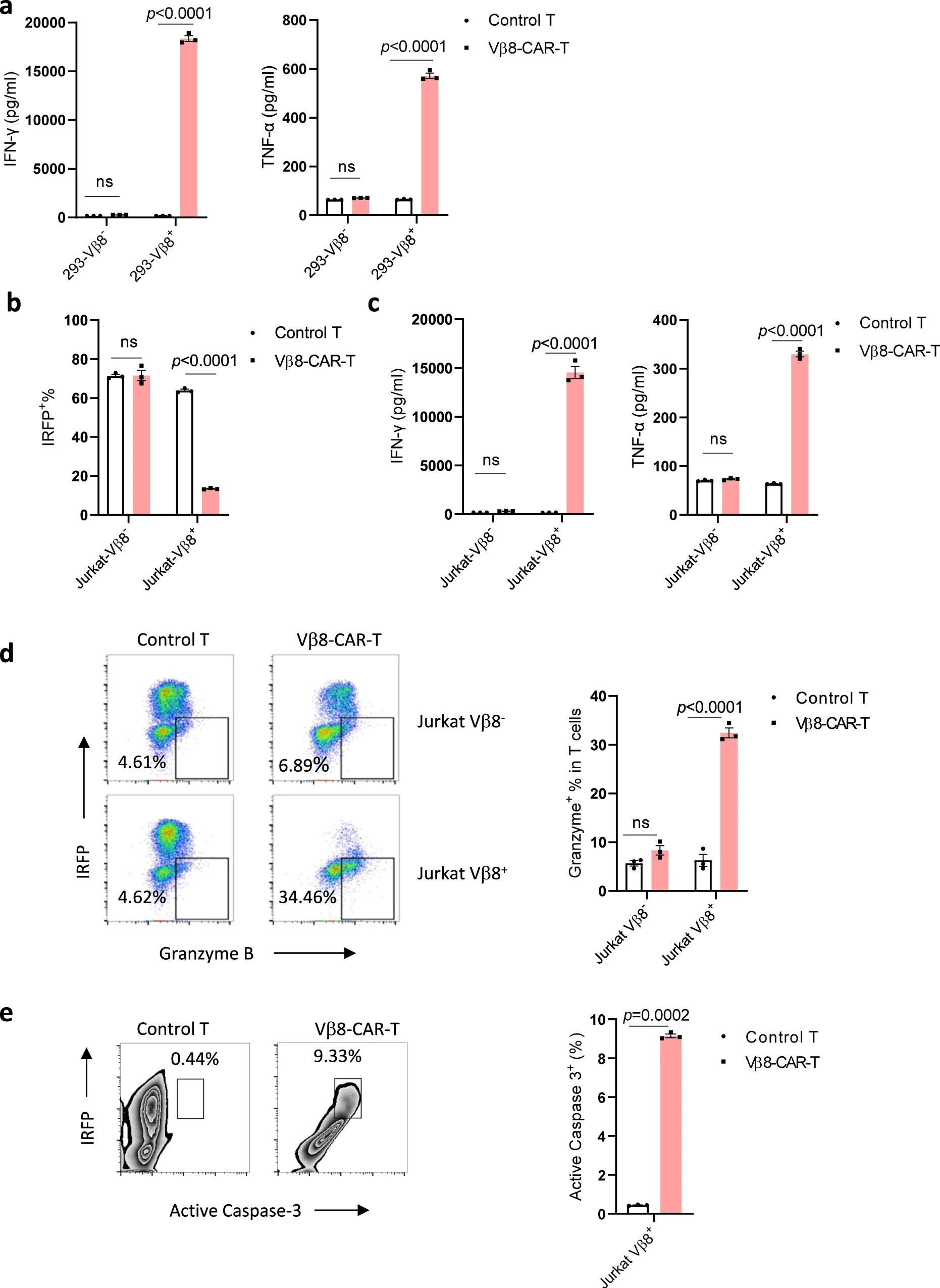
接下来,作者利用293细胞和Jurkat细胞分别构建配对的Vβ8-和Vβ8+细胞,并与对照T细胞或Vβ8-CAR-T细胞共培养,发现只有当Vβ8+细胞与Vβ8-CAR-T细胞共培养时,才能检测到T细胞IFN-γ、TNF-α的释放,以及granzyme B的表达,Vβ8+ Jurkat细胞才能被特异性杀伤,并且激活的caspase-3表达水平显著上升,表明细胞凋亡增加。
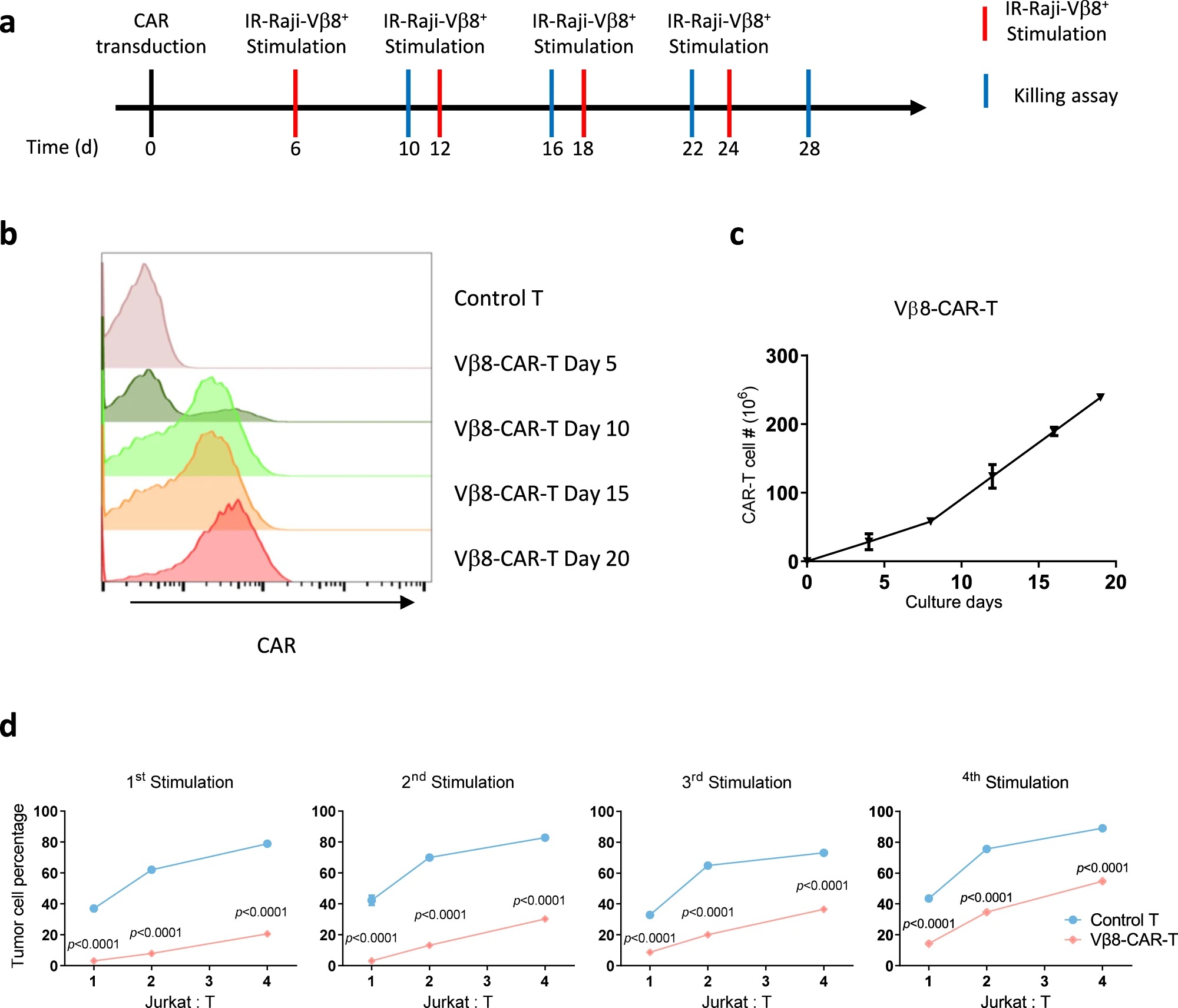
为了检测CAR-T细胞长期增殖和细胞毒性杀伤能力,作者利用辐照的Vβ8+ Raji细胞作为抗原持续重复刺激Vβ8-CAR-T细胞。通过检测多个不同供体来源的CAR-T细胞,作者发现这种重复的抗原刺激能够不断增加Vβ8-CAR-T细胞数目,无需为T细胞扩增做额外的基因改造,也没有出现靶向CD3或CD5的CAR-T细胞中互相杀伤的现象。而细胞毒性检测实验表明,与对照T细胞相比,不同刺激阶段的Vβ8-CAR-T细胞均能显著提升对Vβ8+ Jurkat细胞的杀伤。
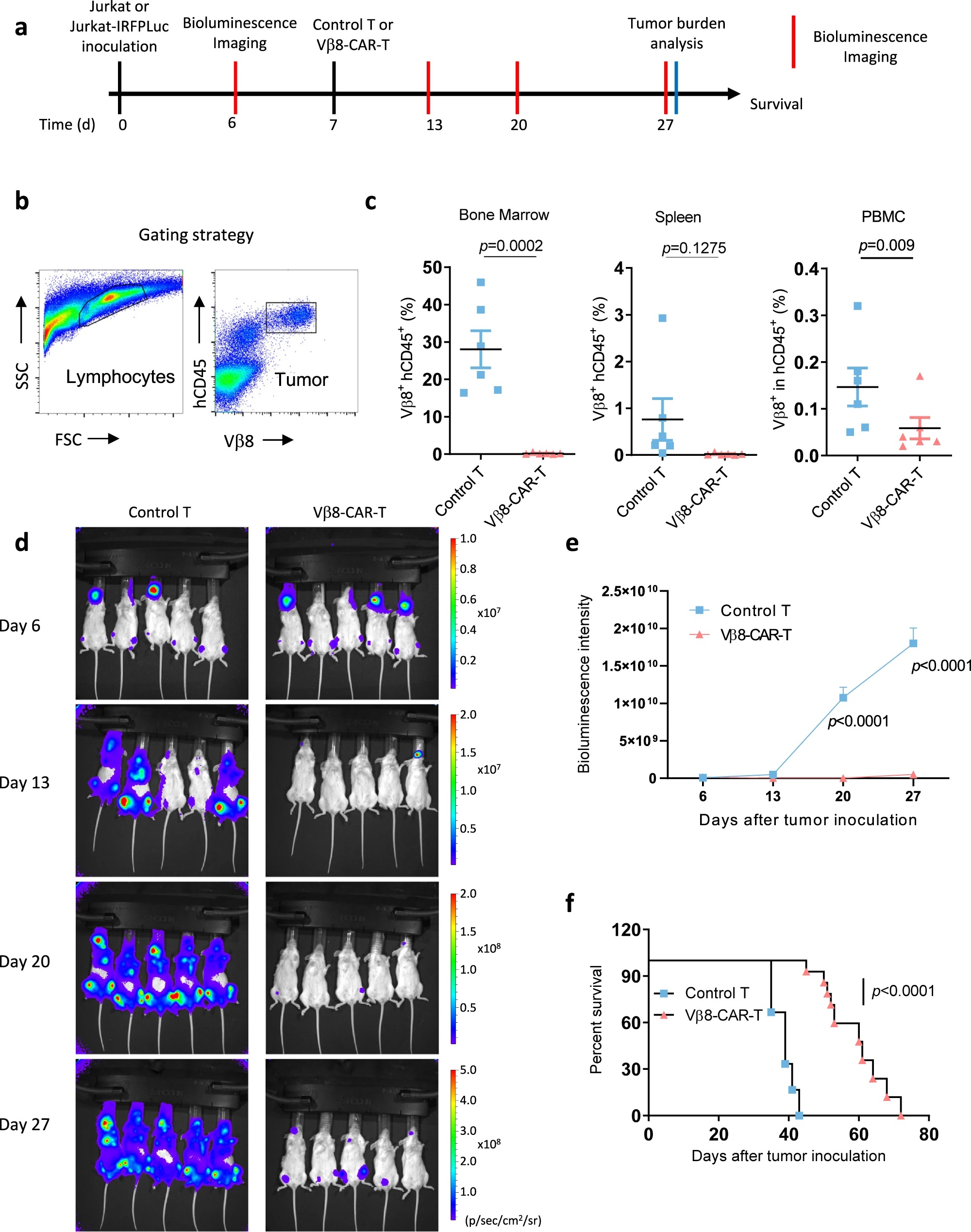
作者进一步在体内验证Vβ8-CAR-T细胞的抗肿瘤效果,他们用免疫缺陷的NSG小鼠建立Jurkat细胞异种移植模型,静脉注射对照T细胞或者Vβ8-CAR-T细胞,结果表明经Vβ8-CAR-T细胞治疗的小鼠,流式检测其外周血、脾脏和骨髓中的肿瘤细胞数目明显降低,活体成像显示各时间点肿瘤负荷明显减少,总生存率显著提升。
利用Vβ8靶点证明靶向Vβ的策略有效后,作者并不满足于此,希望将适用范围拓展到其他T淋巴细胞肿瘤。为此,作者构建了Vβ5-CAR-T细胞,以及Vβ5阳性的肿瘤细胞CCRF-CEM和Hut-78 T细胞系。与靶向Vβ8的实验结果一致,在Vβ5-CAR-T细胞制备的过程中,自身表达Vβ5的正常T细胞被清除。体外共培养实验中,Vβ5-CAR-T细胞能够特异性杀伤Vβ5+的CCRF-CEM和Hut-78 T细胞,并且仅在它与Vβ5+细胞共培养时分泌IFNγ。同样在体内实验中,Vβ5-CAR-T细胞注射能够显著降低Vβ5+的CCRF-CEM异种移植肿瘤负荷,并且显著延长荷瘤小鼠生存期。

靶向Vβ的策略虽然显示较好的抗肿瘤效果,但仍存在一定风险,CAR-T细胞会攻击自身表达所靶向Vβ亚型的正常T细胞,故作者接下来对这一策略安全性进行评估。因为体内某特定Vβ亚型的T细胞仅占所有T细胞的一小部分,作者猜测相比于靶向所有T细胞(例如CD5、CD7或CD3)的CAR-T治疗策略,这一小部分T细胞的缺失不会产生严重的免疫抑制。为了验证这一猜想,作者建立了选择性去除Vβ8+ T细胞的小鼠模型。Vβ8特异性抗体的检测表明小鼠中Vβ8+ T细胞约占总正常T细胞的21.5%。作者利用相同scFv片段制备Vβ8重组抗体,模拟长期Vβ8+ T细胞的缺失,并用CD3ε抗体处理的小鼠作为阳性对照。
随后作者对该小鼠模型注射DEC-OVA疫苗,发现Vβ8抗体处理的小鼠产生DEC-OVA抗体的水平,以及OT-I特异的T细胞应答水平与野生型小鼠类似,而CD3ε抗体处理的小鼠产生的DEC-OVA抗体显著减少,OT-I特异的T细胞应答则完全被抑制。作者进一步对接种B16-OVA肿瘤细胞的小鼠进行抗肿瘤免疫检测,发现Vβ8+ T细胞缺失小鼠的肿瘤生长曲线与野生型小鼠基本一致,而由CD3ε抗体处理后所有T细胞缺失的小鼠肿瘤生长更加迅速。因此Vβ8+ T细胞缺失的小鼠细胞和体液免疫反应几乎不受影响。

综上所述,文章利用TCR β链可变区的特定亚型作为靶点,建立特异性的CAR-T细胞治疗策略,并证明该策略能够有效杀伤特定亚型的T细胞恶性肿瘤,同时保留充分的适应性免疫功能,对临床有一定的指导意义。

扫一扫,反馈当前页面
和元生物