
Nat Neurosci. | 新型AAV血清型,静脉到脑,一针注射,全脑表达,肝脏低靶向性!
血脑屏障介于血液和脑组织之间,由脑的连续毛细血管内皮及其细胞间的紧密连接、基膜、周细胞以及星形胶质细胞构成,能够选择性地透过中枢神经系统需要的成分,阻碍有害成分。
血脑屏障是中枢神经系统一道重要的物理屏障,保障神经系统正常功能的作用。但是当脑生病的时候,血脑屏障反而成了疾病的保护伞:对于脑肿瘤、帕金森、精神分裂症等大量中枢神经系统疾病,绝大部分药物都会被血脑屏障无情的拒之门外。因此,迫切需要有效突破血脑屏障的药物递送策略。

早在2017年,该团队与Benjamin E Deverman团队开展合作,构建了AAV-PHP.eB血清型病毒,它能够通过静脉注射高效穿越血脑屏障,实现全脑表达的目的,但同时也会在肝脏富集。
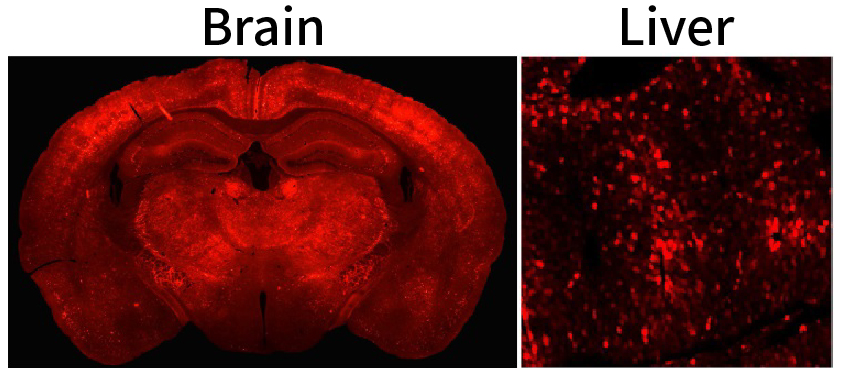
图片来源( doi: 10.7150/thno.46992. )
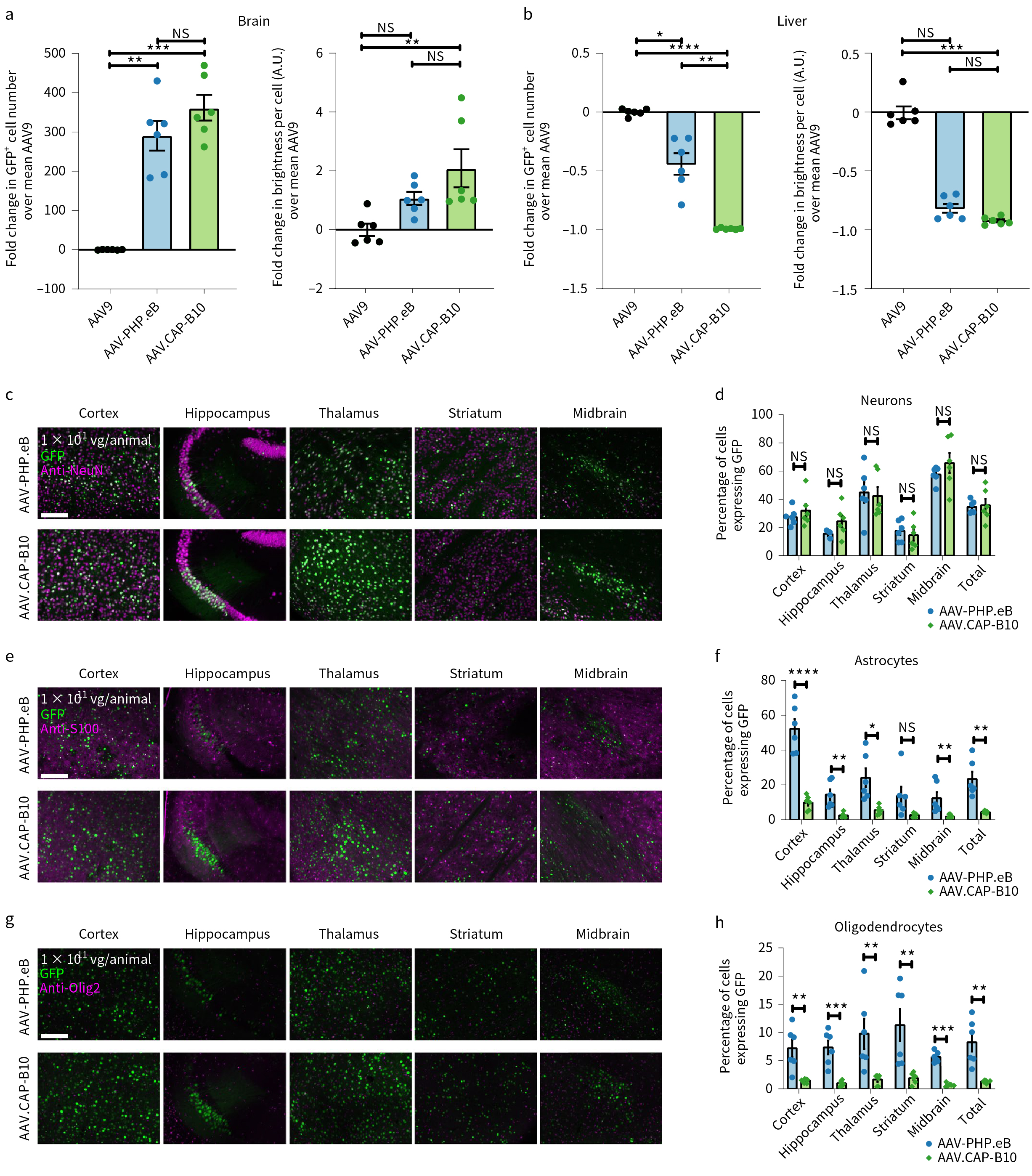
而全新的AAV.CAP-B10血清型病毒,通过静脉注射,对中枢神经系统具有高度特异性,靶向神经元。该研究团队对比了三种不同的AAV血清型通过静脉注射在各组织器官中的递送效率(pAAV-CAG-NLS-GFP,1x1011vg,3周切片),结果发现,AAV.CAP-B10表现出对中枢神经系统具有高度特异性和肝脏的低靶向性;同时,脊髓中,AAV.CAP-B10的递送效率比AAV-PHP.eB弱约40%,但比AAV9高约16倍。
病毒载体除了在基础研究领域促进我们对脑的认知,其还是绝佳的基因治疗药物载体。2017年12月和2019年5月,FDA分别批准了来自Spark Therapeutics的基因治疗药物Luxtunra(Voretigene Neparvovec-rzyl)和来自Novartis的基因治疗药物Zolgensma(Onasemnogene Abeparvovec-xioi)上市。其中Luxtunra以AAV2为载体,通过视网膜下腔注射的方式将功能性RPE65基因递送至患者的视网膜色素上皮细胞中,促使功能性RPE65酶的表达,从而恢复患者正常的视觉循环。治疗双等位RPE65基因突变相关的视网膜营养不良。Zolgensma则以AAV9为载体,通过静脉注射的给药形式,将功能性SMN1基因递送至患者体内,促使SMN蛋白的表达,从而恢复受损的运动神经元,用于治疗脊髓性肌肉萎缩。
非人灵长类动物(Non-human Primate, NHP)的大脑组织和结构与人脑非常相似,是脑科学研究很好的模型,近年来,随着病毒载体的不断发展,其已成为NHP脑研究不可或缺的关键基因递送工具。
该研究团队通过狨猴静脉注射对比了AAV9、AAV-PHP.eB 、AAV.CAP-B10三种不同血清型病毒在NHP中枢神经系统中的传导效率(7x1013vg/kg),发现AAV.CAP-B10表现出与小鼠类似的性质,对中枢神经系统具有高度特异性和肝脏的低靶向性,且靶向神经元。

业务咨询


扫一扫,反馈当前页面
和元生物