
Neuron | 彭勃等人提出了验证胶质细胞转分化的基本原则,并证明NeuroD1不能介导小胶质细胞-神经元重编程

图1 论文首页
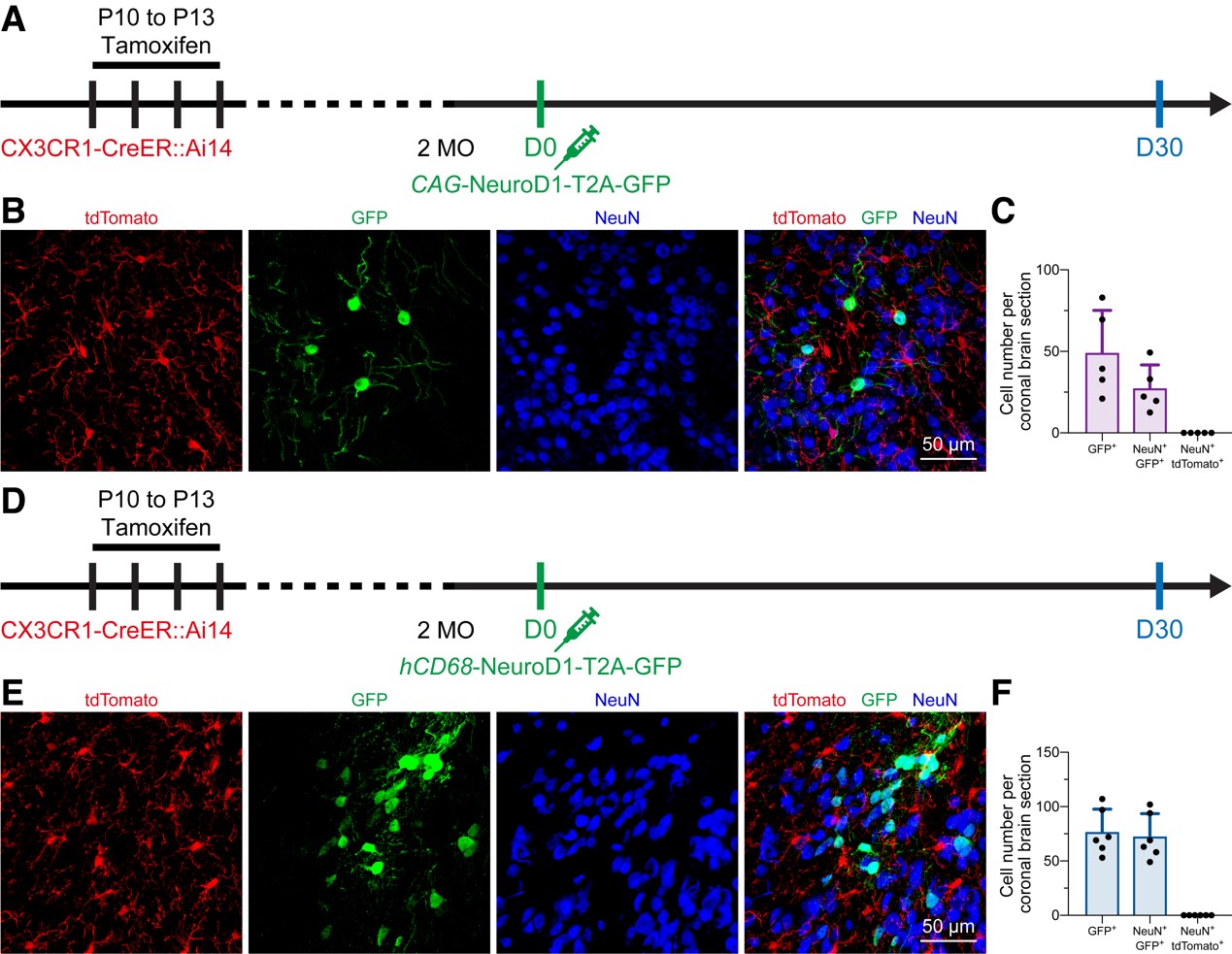
图2 In vivo microglia-specific lineage tracing does not support the microglia-to-neuron conversion.
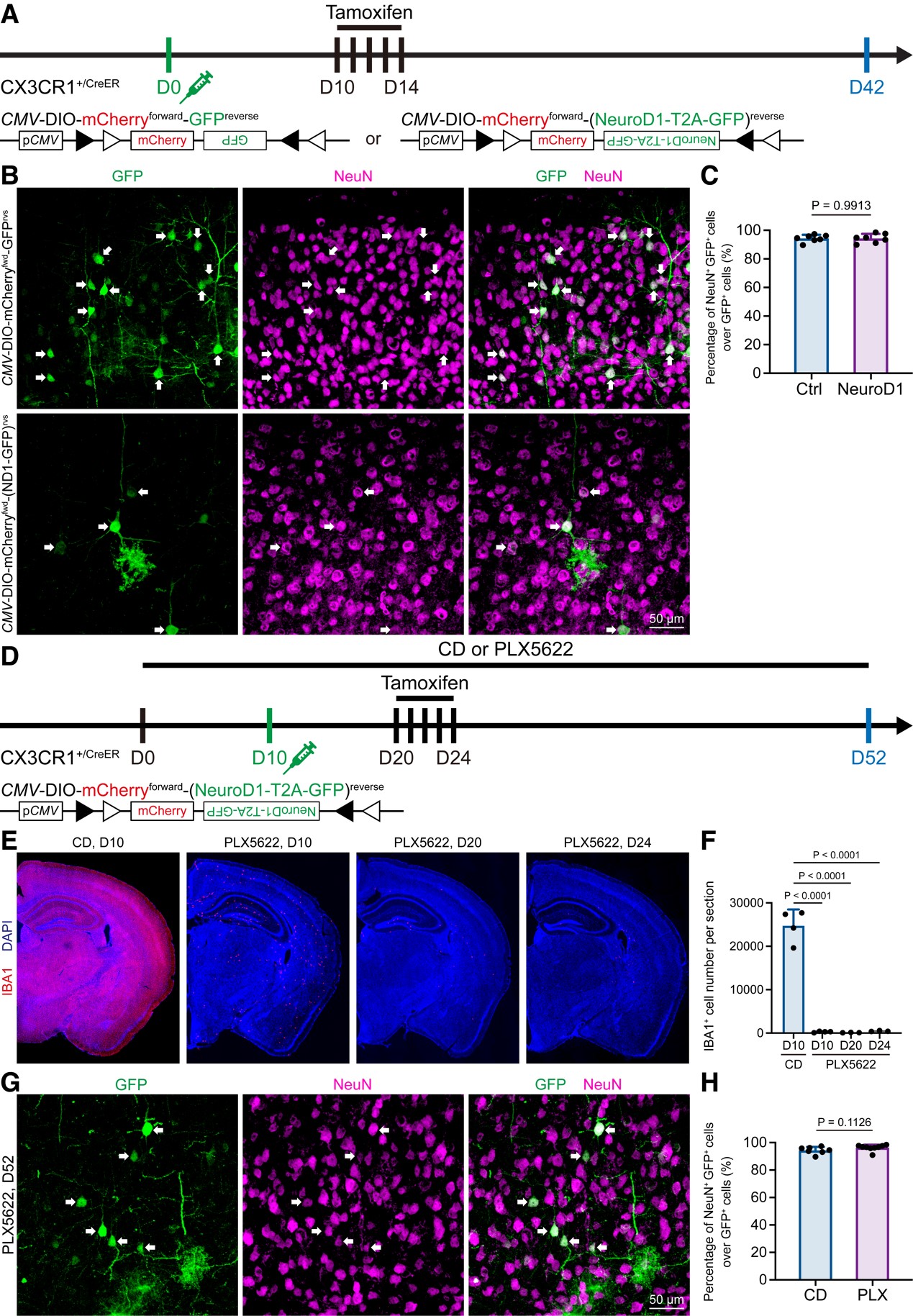
图3 Lentivirus induces non-specific labeling in vivo, which may confound the microglia-to-neuron observation.
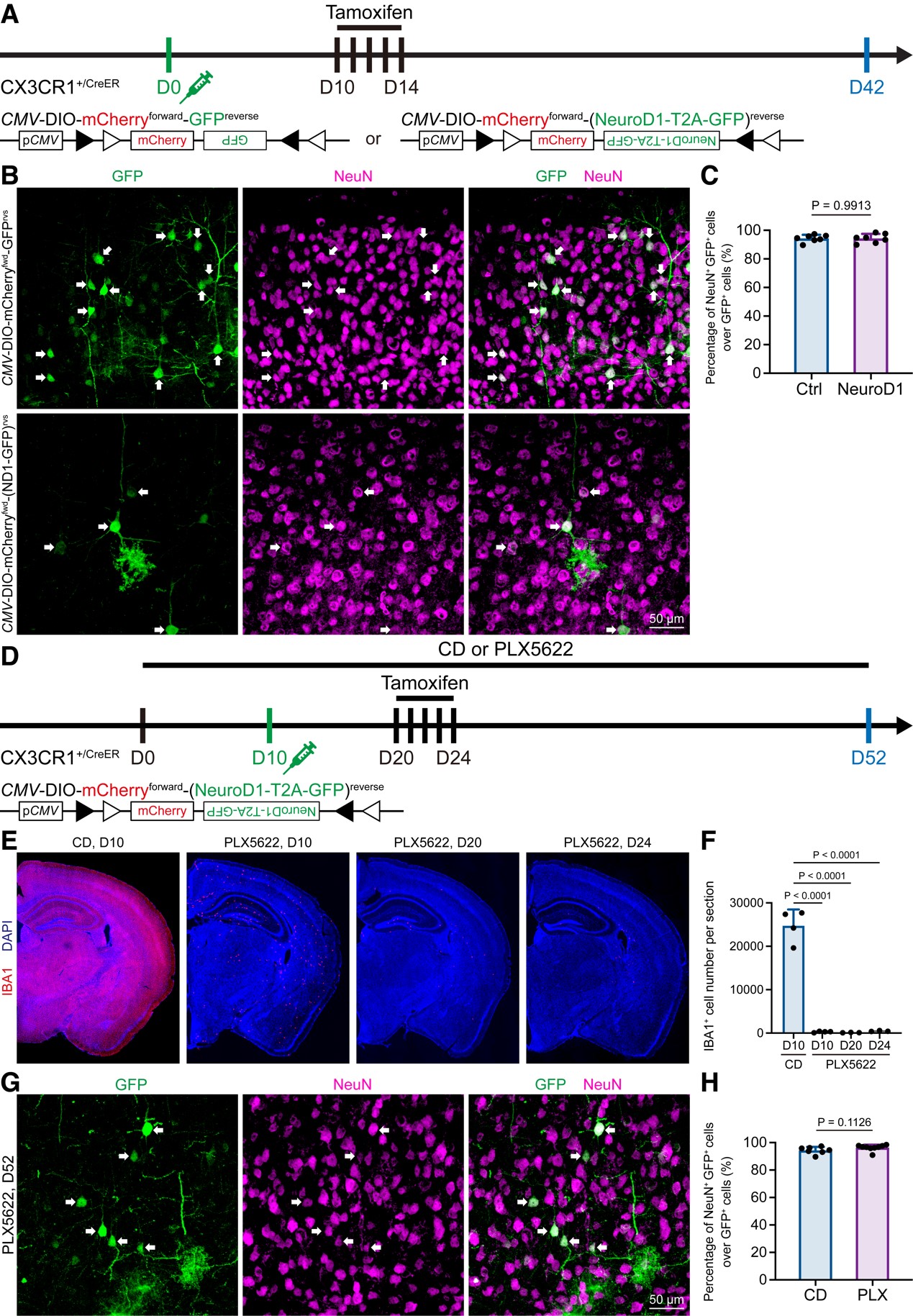
图4 Even under microglia depleted brain, the “microglia-converted neurons” are detected, reflecting a lentiviral leakage artifact.
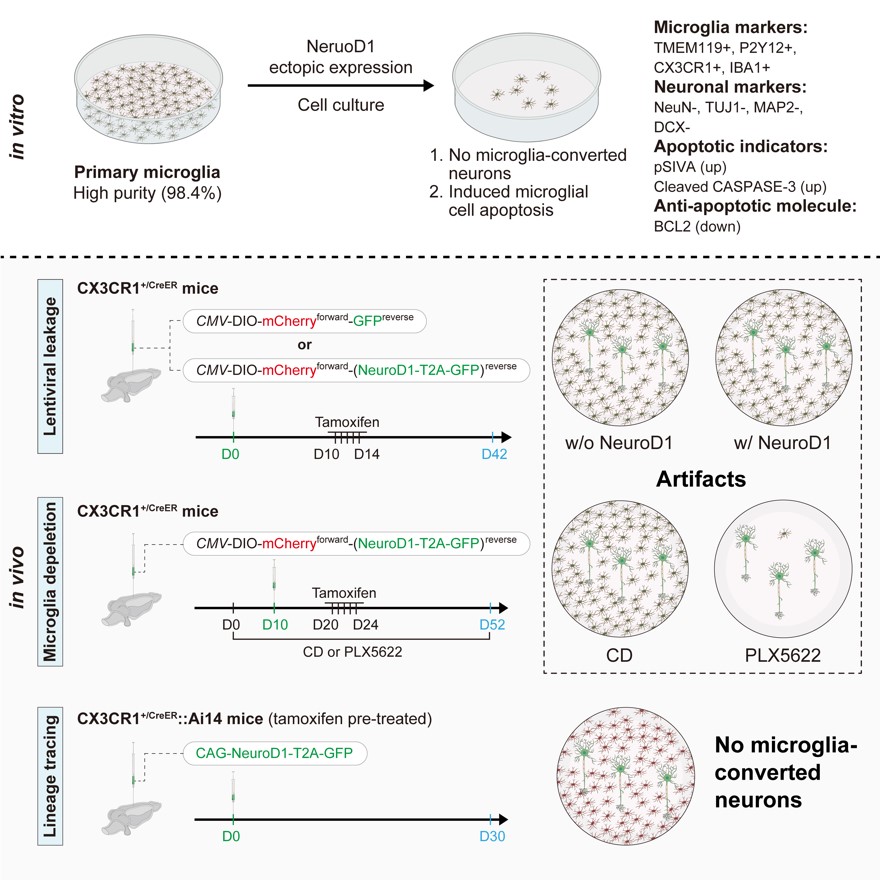
图5 该研究主要结论的总结。
换/移植小胶质细胞失控的分子开关
原文链接:
https://www.cell.com/neuron/fulltext/S0896-6273(21)00944-2
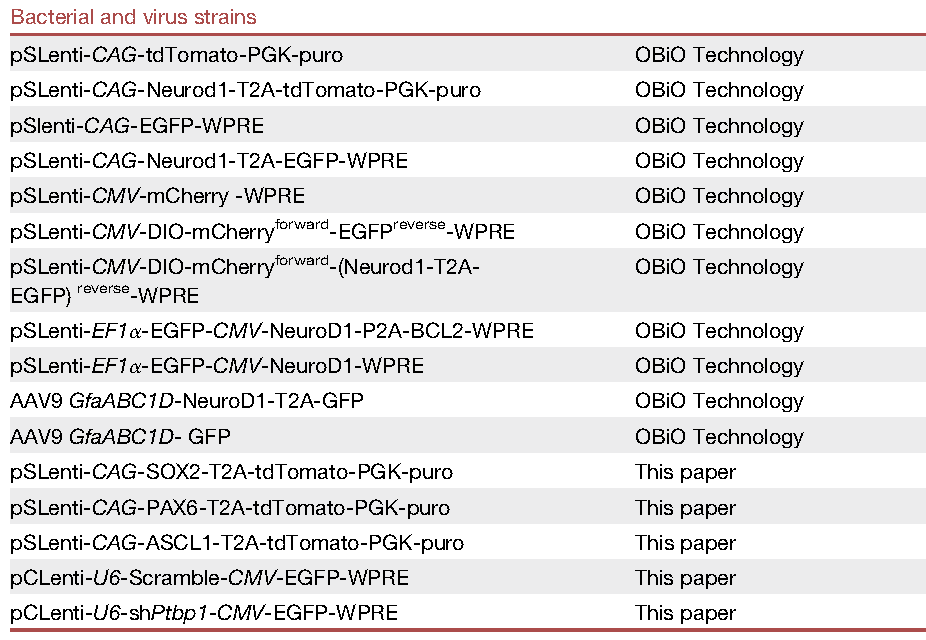
附:彭勃课题组2018-2021年发表的代表性论文
(1) Rao Y.*, Du S., Yang B., Wang Y., Li Y., Li R., Zhou T., Du X., He Y., Wang Y., Zhou X., Yuan T.-F.*, Mao Y.* and Peng B.* (2021) NeuroD1 induces microglial apoptosis and cannot induce microglia-to-neuron cross-lineage reprogramming, Neuron, 109.
(2) Huang Y.#, Xu, Z.#, Xiong S., Sun F., Qin G., Hu G., Wang J., Zhao L., Liang Y.-X., Wu T., Lu Z., Humayun M.S., So K.-F., Pan Y., Li N., Yuan T.-F.*, Rao Y.* and Peng B.* (2018). Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion. Nature Neuroscience 21, 530-540.
(3) Xu Z.#, Rao Y.#, Huang Y., Zhou T., Feng R., Xiong S., Yuan T.F., Qin S., Lu Y., Zhou X., Li X., Qin B., Mao Y., and Peng B.* (2020). Efficient strategies for microglia replacement in the central nervous system. Cell Reports 32, 108041.
(4) Huang Y.#, Xu Z.#, Xiong S., Qin G., Sun F., Yang J., Yuan T.F., Zhao L., Wang K., Liang Y.X., Fu L., Wu T., Lu Z., So K.F., Rao Y.* and Peng B.* (2018) Dual origins of retinal microglia in the model of microglia repopulation. Cell Discovery 4, 9.
(5) Xu, Z., Zhou, X., Peng, B.*, and Rao, Y.* (2021). Microglia replacement by bone marrow transplantation (Mr BMT) in the central nervous system of adult mice. STAR Protocols 2, 100666.
(6) Xu, Z., Rao, Y.*, and Peng, B.* (2021). Protocol for microglia replacement by peripheral blood (Mr PB). STAR Protocols 2, 100613.
(7) Xu, Z., Peng, B.*, and Rao, Y.* (2021). Microglia replacement by microglia transplantation (Mr MT) in the adult mouse brain. STAR Protocols 2, 100665.
参考文献
1.Heins, N. et al. Glial cells generate neurons: the role of the transcription factor Pax6. Nature neuroscience 5, 308-315, doi:10.1038/nn828 (2002).
2.Guo, Z. et al. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer's disease model. Cell stem cell 14, 188-202, doi:10.1016/j.stem.2013.12.001 (2014).
3.Chanda, S. et al. Generation of induced neuronal cells by the single reprogramming factor ASCL1. Stem Cell Reports 3, 282-296, doi:10.1016/j.stemcr.2014.05.020 (2014).
4.Borges, K., McDermott, D., Irier, H., Smith, Y. & Dingledine, R. Degeneration and proliferation of astrocytes in the mouse dentate gyrus after pilocarpine-induced status epilepticus. Exp Neurol 201, 416-427, doi:10.1016/j.expneurol.2006.04.031 (2006).
5.Huang, Y. et al. Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion. Nature neuroscience 21, 530-540, doi:10.1038/s41593-018-0090-8 (2018).
6.Matsuda, T. et al. Pioneer Factor NeuroD1 Rearranges Transcriptional and Epigenetic Profiles to Execute Microglia-Neuron Conversion. Neuron 101, 472-485 e477, doi:10.1016/j.neuron.2018.12.010 (2019).
7.Wang, L.-L. et al. Revisiting astrocyte to neuron conversion with lineage tracing in vivo. Cell, doi:https://doi.org/10.1016/j.cell.2021.09.005 (2021).
8.Rao, Y. et al. NeuroD1 induces microglial apoptosis and cannot induce microglia-to-neuron cross-lineage reprogramming. Neuron 109 (2021).
9.Xu, Z., Peng, B. & Rao, Y. Microglia replacement by microglia transplantation (Mr MT) in the adult mouse brain. STAR Protoc 2, 100665, doi:10.1016/j.xpro.2021.100665 (2021).
10.Xu, Z., Zhou, X., Peng, B. & Rao, Y. Microglia replacement by bone marrow transplantation (Mr BMT) in the central nervous system of adult mice. STAR Protoc 2, 100666, doi:10.1016/j.xpro.2021.100666 (2021).
11.Xu, Z., Rao, Y. & Peng, B. Protocol for microglia replacement by peripheral blood (Mr PB). STAR Protoc 2, 100613, doi:10.1016/j.xpro.2021.100613 (2021).
12.Xu, Z. et al. Efficient Strategies for Microglia Replacement in the Central Nervous System. Cell reports 32, 108041, doi:10.1016/j.celrep.2020.108041 (2020).

扫一扫,反馈当前页面
和元生物