
Nat Commun︱徐州医科大学曹君利/安述明团队揭示慢性疼痛-睡眠障碍共病的神经机制
慢性疼痛和睡眠障碍是世界范围内的主要公共健康问题[1, 2]。二者之间相互影响,存在明显的双向关系。一方面,慢性疼痛会影响睡眠[3, 4]。而另一方面,睡眠障碍会增加疼痛敏感性、发生率和严重程度[1, 5, 6]。二者之间往往相互影响,形成恶性循环。
临床研究发现,高达88% 的慢性疼痛患者患有睡眠障碍,而至少有50% 的睡眠障碍患者同时经受慢性疼痛的折磨[6]。为什么慢性疼痛会引起失眠,而睡眠减少又会加剧慢性疼痛?二者是怎样相互影响并形成恶性循环?长期以来人们对慢性疼痛-睡眠障碍共病的发病机理知之甚少,临床上也没有有效治疗这一共病的药物及方法。因此,研究慢性疼痛-睡眠障碍共病的神经机制具有重要的临床价值和科学意义。
伏隔核 (nucleus accumbens,NAc)除了参与奖赏、动机、学习等行为的调控外[7],在疼痛的发生发展和调控中也发挥着重要的作用[8-12]。另一方面,越来越多的临床和动物研究表明,NAc还参与睡眠/觉醒的调控。但是,NAc中调控疼痛和睡眠/觉醒的神经元之间存在怎样的关系?它们是否是同一神经元?还有待深入研究。
2023年8月5日,徐州医科大学麻醉学重点实验室曹君利教授、安述明教授课题组在Nature Communications上发表了题为“A common neuronal ensemble in nucleus accumbens regulates pain-like behaviour and sleep”的论文,揭示了慢性疼痛-睡眠障碍共病的神经机制——伏隔核神经元集群同时编码伤害性感受和调控睡眠/觉醒行为,这一神经元集群通过视前区及中脑腹侧被盖区这两条不同的通路分别调控睡眠和疼痛两种不同模式的生理反应。该研究不仅揭示慢性疼痛-睡眠障碍共病的发病机理,也为慢性疼痛-睡眠障碍的临床治疗策略提供了新的思路。孙海艳博士和硕士研究生李峙林为论文的共同第一作者。曹君利教授和安述明教授为论文的共同通讯作者。

研究者利用c-fos和Tet-off系统标记慢性疼痛激活的一群伏隔核神经元。并应用光电极记录这群神经元的放电活动,发现这群神经元在小鼠觉醒时或给予小鼠阈下机械刺激时均表现出放电频率显著增加。而非慢性疼痛激活的神经元在小鼠觉醒或给予小鼠阈下机械刺激前后放电频率无显著变化(图1)。这些结果表明:伏隔核中这群由慢性疼痛激活的神经元集群不仅参与处理疼痛感知还调控睡眠/觉醒行为。
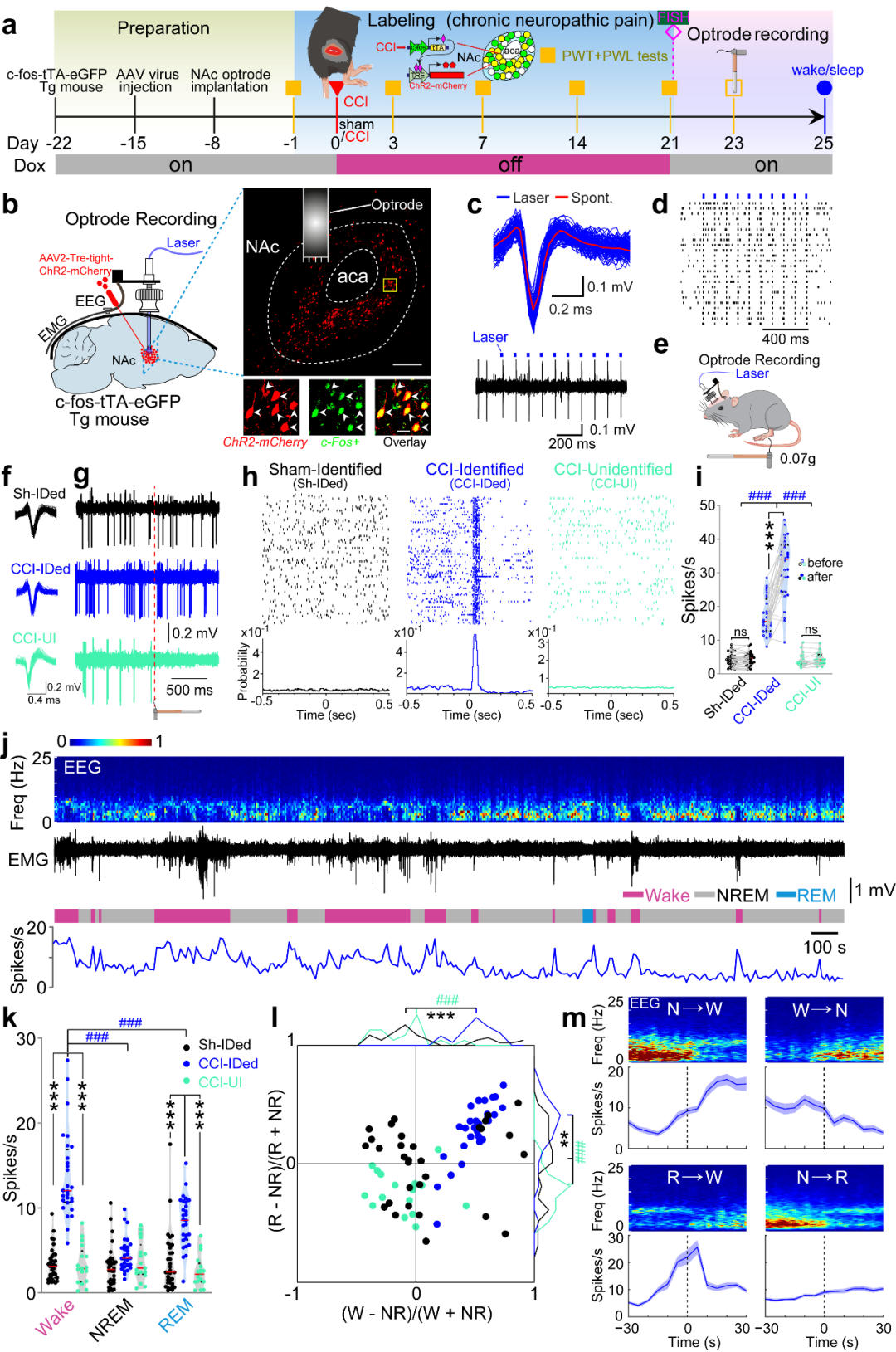
为了进一步明确伏隔核中由慢性疼痛激活的这一神经元集群(NAc ensemble)在疼痛感知及睡眠/觉醒行为中的作用,研究者利用c-fos和Tet-off系统结合光遗传学方法,发现激活NAc ensemble不仅加剧小鼠的疼痛样行为还减少小鼠的非快动眼睡眠;而光遗传学激活伏隔核中非慢性疼痛激活的神经元(NAc non-ensemble),小鼠的疼痛反应和睡眠/觉醒行为没有显著变化(图2)。

随后,研究者利用多通道荧光原位杂交技术检测NAc ensemble神经元亚型,发现NAc ensemble主要由多巴胺1型受体神经元组成(D1 neurons)(图3)。

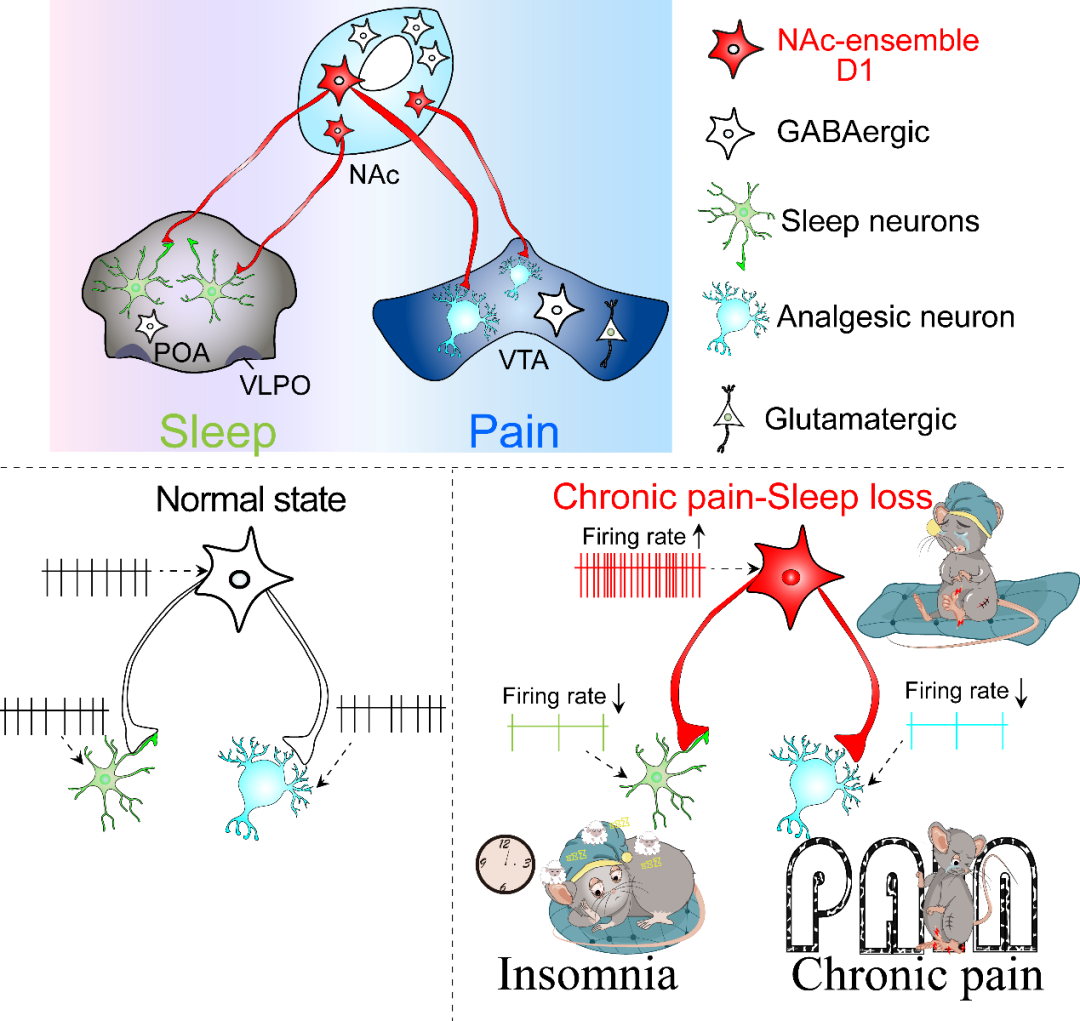
研究者推测NAc ensemble之所以能够调节两种截然不同的生理模式可能是由于这一神经元集群调控不同的下游脑区的活动。为此,他们进行了顺行和逆行病毒示踪实验,结果显示, NAc ensemble分别投射至视前区(POA)(调控睡眠的关键脑区)和腹侧被盖区(VTA)(调控疼痛的脑区)及其他几个脑区如外侧下丘脑、腹外侧水管周围灰质等,原位杂交结果显示NAc ensemble主要为中型多棘GABA能神经元(图4)。因此NAc ensemble主要通过GABA能抑制下游脑区活动。而在这些下游脑区中,视前区和腹侧被盖区是调控睡眠和疼痛的关键脑区。因此,研究者重点关注这两个下游脑区。
图4 NAc ensemble投射至POA 和VTA
进一步的研究发现,光遗传学抑制NAc ensemble支配的POA神经元促进小鼠觉醒但不影响其疼痛样行为;而光遗传学抑制NAc ensemble支配的VTA神经元加剧小鼠的疼痛样行为但不影响其睡眠(图5)。这些结果表明NAc ensemble通过两条不同的神经通路分别调控睡眠/觉醒和疼痛样行为实现其双重功能。

文章结论与讨论,启发与展望
该研究表明,伏隔核中存在一神经元集群(NAc ensemble),这一神经元集群同时编码伤害性感受和调控睡眠/觉醒行为,NAc ensemble通过视前区和中脑腹侧被盖区这两条不同的通路分别调控睡眠和疼痛两种不同模式的生理反应(图6)。这些发现不仅揭示慢性疼痛-睡眠障碍共病的发病机理,也为慢性疼痛-睡眠障碍的临床治疗策略提供了新的见解。本文主要阐述了NAc ensemble通过视前区及腹侧被盖区这两条不同的通路分别调控睡眠/觉醒和疼痛这两种不同模式的生理反应,但是不排除其他潜在的神经环路可能也参与了睡眠-疼痛的调节,这些还有待于进一步的研究发现。
原文链接:https://www.nature.com/articles/s41467-023-40450-3
和元助力
和元生物有幸为研究者提供实验中使用的AAV工具病毒载体,包括光遗传、逆行示踪病毒、顺行跨单突触病毒等(下表),以实际行动助力神经科学研究!
| AAV2-Tre-tight-ChR2-mCherry |
| AAV2-Tre-tight-eNpHR-mCherry |
| AAV2-Tre-tight-ChR2-eGFP |
| rAAV2-retro-hSyn-mCherry |
| rAAV2-retro-hSyn-eGFP |
| pAAV1-PTRE-tight-NLS-Cre |
| pAAV-EF1α-DIO-hChR2(H134R)-eYFP |
| AAV8-Ef1a-DIO-eNpHR-mCherry |
业务咨询
更多活动详情可咨询(微信/电话):15800353038

扫一扫,反馈当前页面
和元生物