
欧洲首个用于B型血友病的基因疗法|Hemgenix获欧盟委员会批准上市
文章来自细胞与基因治疗领域,转载请注明出处
新闻速递

2023年2月20日,CSL(澳交所代码:CSL)宣布基因疗法Hemgenix(etranacogene dezaparvovec)获得欧盟委员会的有条件营销授权(CMA),这是欧盟委员会批准的首款治疗血友病B成人患者的基因疗法!此疗法由荷兰生物技术公司UniQure开发,由澳大利亚制药公司CSL Behring销售。2022年11月,Hemgenix(etranacogene dezaparvovec)已获得FDA批准在美国上市。
相关阅读
点击下方文字跳转
【行业资讯】里程碑!FDA批准首款B型血友病基因治疗药物Hemgenix上市
Hemgenix是一款基于AAV5载体的基因疗法,该药物搭载有凝血因子IX(FIX)基因变体(FIX-Padua),通过静脉给药,给药后该基因可在肝脏中表达FIX 凝血因子,分泌后进入血液发挥凝血功能,从而达到治疗目的,理论上一次给药长期有效。
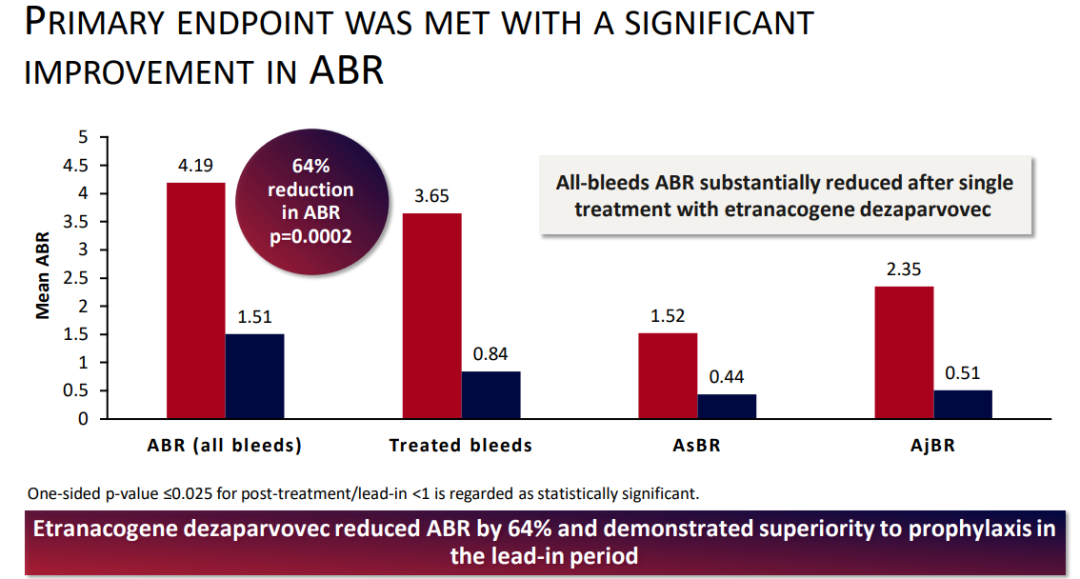
HOPE-B研究主要终点数据(来源:uniQure)
在两项针对Hemgenix的临床研究中,对 57 名 18 至 75 岁患有重度或中重度血友病 B 的成年男性进行了药物安全性和有效性评估,其有效性是根据男性年出血率 (ABR) 的下降情况确定的。在一项有 54 名参与者的研究中(HOPE-B trial),与基线相比,受试者的FIX活性增加,对常规FIX蛋白替代预防治疗的需求减少,ABR 降低。此外,与 Hemgenix 相关的最常见不良反应包括肝酶升高、头痛和流感样症状等。
2022年11月Hemgenix获得美国食品和药物管理局(FDA)批准上市,Hemgenix 售价为 350 万美元,最近被评为世界上最昂贵的药物,取代了另一种售价300万美元的基因疗法Skysona,以及排名跌至第三的售价280万美元的基因疗法Zynteglo。
免责声明
* 文章内容来源于“细胞与基因治疗领域”公众号,转载文章不代表平台立场,如有涉及版权问题,请及时与我们联系(微信moyachy0724),我们将给予删除或下线处理。

扫一扫,反馈当前页面
和元生物