
慢病毒系列|收下这篇集锦,轻松拿捏慢病毒
就要做慢病毒实验了,却无从下手?
实验前都要做哪些准备呢?
什么是MOI?选个什么样的细胞呀?怎样提高病毒感染效率?
为什么慢病毒感染后细胞状态变差?荧光不亮又是怎么回事呢?
……
知己知彼才能战胜我们遇到的问题,跟随小编来了解一下今天的主角——慢病毒。
和元生物●慢病毒的安全性
和元生物提供慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷Ⅰ型病毒)为基础经过人工构建的重组慢病毒,不会利用宿主细胞产生新的病毒颗粒再去感染其他细胞,且病毒中的毒性基因已被外源性目的基因所取代,属于假型病毒。操作上相对安全,但在使用过程中仍需要遵守安全使用规范:
实验前:规范穿着及佩戴实验服、手套、口罩和帽子;
实验中:在BSL-2实验室的生物安全柜中操作,避免对病毒进行操作时产生飞溅;
实验后:接触过病毒的耗材需加入84消毒液(10:1)浸泡24h后处理,相关的废弃物需要收集统一灭菌,用肥皂清洗双手;
※若不小心接触到皮肤,别慌!请立即用大量水冲洗5min,皮肤裸露处可使用酒精喷一下,如有不适请及时就医。
和元生物●慢病毒的包装及侵染细胞的机制
和元生物的慢病毒包装采用三质粒或是四质粒系统进行包装,将包装质粒、包膜质粒以及穿梭质粒共同转染至293T细胞中,通过细胞的培养上清液纯化病毒。慢病毒通过膜融合或内吞的方式进入细胞释放RNA,在逆转录酶、整合酶等的作用形成DNA整合前复合体进入细胞核并随机整合到宿主细胞的基因组中,随后开始转录翻译(如图1)。
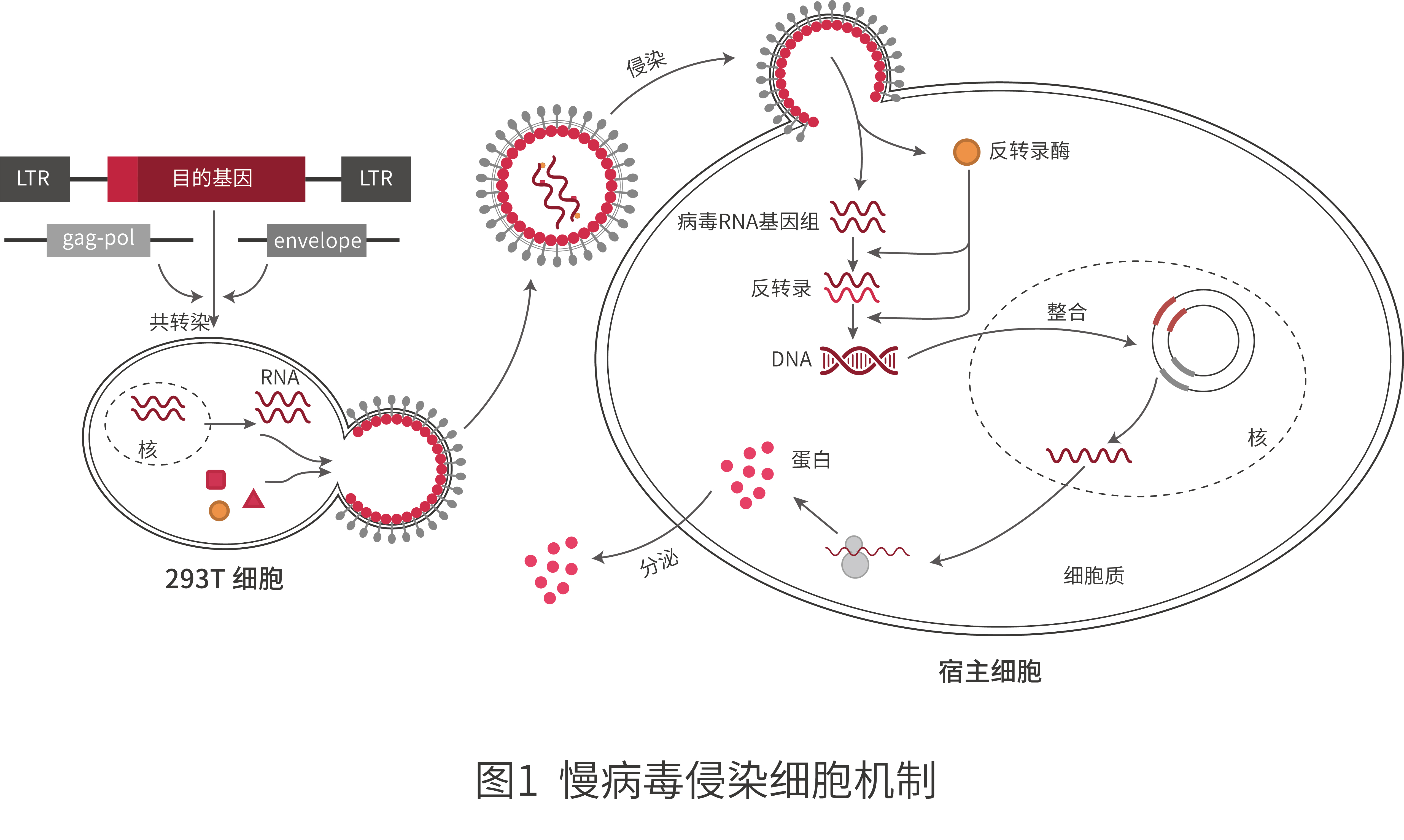
贴心tips:如何提高病毒滴度?
1. 293T细胞处于对数生长期;
2. 质粒浓度大于1mg/mL,且无蛋白、核酸等污染;
3. 于转染后48h和72h两次收毒,提高病毒的量;
4. 和元生物针对编码基因,非编码基因导致的出毒异常,专门开发了已授权的专利——Vpack慢病毒包装系统,解决病毒不出毒, 滴度低的问题。
和元生物●慢病毒的滴度检测
滴度:即单位体积中有感染能力的病毒数目,单位TU/mL,是活性滴度单位,主要是指能够感染并进入细胞中的病毒基因组数量。
常用的滴度检测方法有:
1. 通过酶联免疫吸附测定法对病毒颗粒中的P24蛋白进行检测;
2. 定量PCR对病毒颗粒的RNA拷贝数进行检测;
(1和2两种快速检测方法未考虑到病毒活性,因此是不准确的)
3. 定量PCR对整合到基因组DNA中的病毒拷贝数进行检测,可以准确知道转到细胞的病毒颗粒浓度(和元生物病毒滴度的检测方法)
和元生物●提高慢病毒的感染效率
1. 保证细胞状态良好,正常增殖,轮廓清晰;
2. 确定合适的MOI:可查阅文献,获得目标细胞参考MOI,或进行MOI梯度摸索预实验,设置0/10/20/40/80不同的MOI梯度,在72h后选取感染效率达到80%左右且细胞状态良好的最小MOI值(较低的MOI可以避免细胞毒性的产生);
3. 选择助转剂polybrene,是一种阳离子聚合物,可中和界面电荷促进病毒与细胞膜结合,有效提高10-30%的感染效率;
4. 若是感染悬浮细胞,减少病毒感染时的体积,可提高感染效率。将细胞培板用封口膜密封,水平转子低速离心(<1200g)1h,放回培养箱继续培养;
5. 若是极难感染的细胞可采用重复感染增加感染效率(注意重复感染间细胞的状态)。
※病毒量计算方法:病毒加样量(μL)=(细胞数×MOI/病毒原液滴度)×103
和元生物●慢病毒的使用与保存
慢病毒通常采用干冰运输,若在收到货后3d内使用完,病毒可在4℃短期保存,若长期保存需置于-80℃保存。注意稀释病毒前,病毒需在冰上融化,用PBS或是培养基稀释到相应的浓度,且避免反复冻融降低病毒活性,可进行适当体积的分装。
当你在做慢病毒实验时,可能会遇到很多问题,但有很多共性问题是大部分科研人都会遇到的,小编今天就总结了一些经常遇到的问题以及解决办法,一起来看看吧。
和元生物●慢病毒常见问题
01 什么是MOI?
答:MOI,感染复数,定义为感染时病毒和细胞数量的比值,即平均每个细胞感染的病毒活性单位数。也会反映出病毒对细胞的感染能力,MOI越高,细胞越难被感染。在实验中细胞感染率达到80%的MOI定义为这种细胞的最适MOI。
02 慢病毒感染细胞后,目的基因或干扰序列的表达是瞬时表达还是稳定表达?
答:因为慢病毒具有整合外源序列至宿主基因组中的能力,因此外源序列是稳定表达,并随细胞的增殖分化一起复制并遗传到子细胞中。
03 慢病毒载体可以作为常规的过表达质粒进行使用吗?
答:可以,但慢病毒载体骨架较大,整个质粒较普通真核载体大,会影响转染效率。
04 病毒感染细胞后为何状态会变差?
答:
1. 病毒感染换液时间不宜超过24h;
2. 外源表达基因与生命活动有关,影响细胞状态;
3. 敏感细胞,MOI过高会对细胞造成伤害。
05 过表达质粒/病毒,为什么目的抗体检测会出现两条带?
答:
1. 标签具有一定大小,外源表达的蛋白要比内源蛋白大一些;
2. 外源表达的蛋白与内源蛋白表达后的修饰有所差异,导致蛋白条带大小不一致;
3. 目的抗体特异性较差,检测到不同的异构体。可尝试标签抗体进行检测。
06 慢病毒感染细胞后基因表达何时达到峰值?
答:一般的细胞在慢病毒感染72h左右GFP或外源序列的表达会达到峰值,生长缓慢的细胞达到峰值的时间会延长。
07 过表达病毒感染后,为什么目的抗体检测不到过表达效果?
答:在保证慢病毒感染效率的条件下,可能存在以下原因:
1. 细胞目的基因内源表达水平太高会影响外源基因的表达,可通过qPCR检测本底表达,选择低表达的细胞系;
2. 目的基因与细胞生长增殖等相关性较高,过表达会影响细胞状态、生长、增殖等,细胞自身调控作用会抑制目的基因的过表达效果;
3. 目的抗体灵敏度或特异性不够,可尝试标签抗体进行检测,检测结果均为外源过表达的蛋白。
08 干扰慢病毒感染后,为什么目的抗体检测不到干扰效果?
答:在保证慢病毒感染效率的条件下,可能存在以下原因:
1. 细胞目的基因内源表达水平太低,很难通过敲减手段使其表达更低,可通过qPCR检测本底表达,选择高表达的细胞系;
2. 目的基因与细胞生长增殖等相关性较高,敲减会影响细胞状态、生长、增殖等,细胞自身调控作用会抑制目的基因的敲减效果;
3. 体内敲减在取材时无法保证只取特异性组织或细胞进行干扰检测,可用原位杂交或是免疫荧光等方式检测;
4. 目的抗体灵敏度或特异性不够,可尝试用qPCR的方法检测。
09 干扰慢病毒感染细胞的MOI是否可直接应用于过表达慢病毒实验?
答:针对同一家公司的病毒,可以参考原来的MOI值,敏感细胞可考虑在原MOI值的基础上,上下选择1-2个梯度进行MOI摸索;若是不同公司的病毒建议重新进行MOI梯度摸索预实验。
10 为什么慢病毒感染后的荧光较弱?
答:荧光蛋白的表达与启动子、表达方式、连接元件等有关
1. 如CMV等强启动子会使荧光表达较强;
2. 融合表达可能会导致荧光蛋白的错误折叠造成检测不到荧光信号或信号较弱;
3. 当过表达基因在荧光蛋白上游时,过表达的基因片段过长或高GC片段会降低下游荧光蛋白的强度,较对照组的荧光弱;
4. 非融合表达时IRES连接元件下游荧光蛋白明显弱于上游的目的基因的表达。
11 慢病毒感染细胞后2-3周,为什么荧光或过表达(干扰)效果没有开始感染时好?
答:随着细胞传代,细胞内部的调控机制会使外源序列表达趋于稳定,因此,较感染最初的瞬时效果可能会出现荧光或过表达(干扰)效果减弱的现象。
12 是否可以在同一稳定株中同时过表达或干扰两个基因?
答:可以,细胞可承受条件下,可将两个基因(靶点)构建到同一载体上或分别构建到两个载体上,并且两个载体的真核抗性不同。
……
没有找到你遇到的问题的解决办法?没关系,更多问题可在留言板中留言或是后台联系小编与你一起解决。也欢迎大家踊跃留下在使用慢病毒时困扰着你的问题。
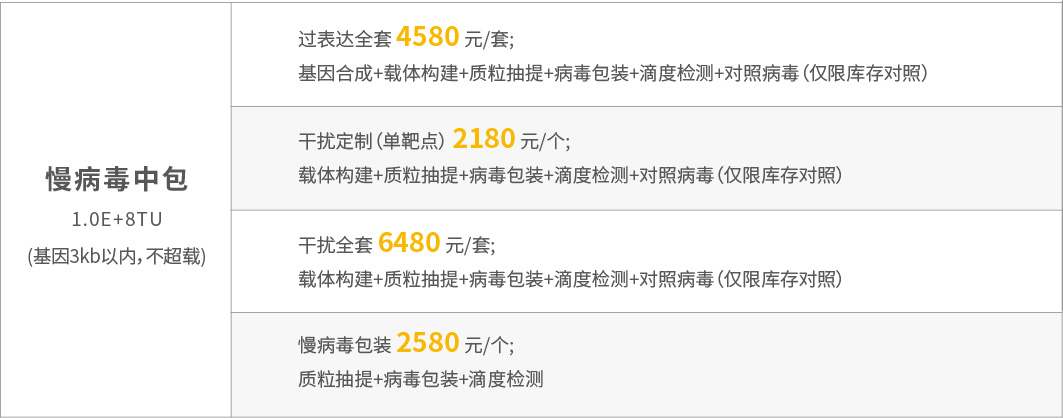
慢病毒大促优惠价
业务咨询联系售前(电话/微信:15800353038)

扫一扫,反馈当前页面
和元生物