
慢病毒系列|让你“随心所欲”调控基因(CRISPR技术应用篇)
以CRISPR/Cas9为基础的基因编辑技术在基因治疗领域的一系列应用都展现出极大的应用前景,如血液病、肿瘤和其他遗传疾病。CRISPR/Cas9在多种类型的细胞和组织中都具有高效、精确的基因编辑能力,目前,CRISPR/Cas9用于人体治疗主要有两种方式。
一种是体外基因编辑,类似于CAR-T,先将细胞从人体取出,在体外进行基因编辑后,重新输回患者体内。目前有多项临床研究将CRISPR-Cas9技术应用于体外靶细胞的基因编辑,对其进行基因改造后重新输注回患者体内,以帮助患者识别和抗击癌症。另一种为体内基因编辑,通过静脉给药利用载体将CRISPR/Cas9基因编辑系统直接递送至病变部位或需要靶向的器官,可直接改造人体内的病变基因,达到治疗的效果。
基因编辑技术的临床转化研究将推动个性化医疗的快速发展。对于体外基因编辑,研发人员可以通过特定的技术,识别脱靶细胞与正常细胞,所以目前体外基因编辑的临床试验进展较快;但体内基因编辑需要直接靶向组织和器官,针对及应用广泛的疾病,需要面临更大的挑战。
慢病毒载体免疫原性低、基因容量大、对分裂期和非分裂期细胞均可进行基因整合、且具有生物安全性等优点,被认为是有效的基因编辑系统递送载体之一。近年来,细胞外泌体与病毒样颗粒已成为CRISPR/Cas9系统递送的新兴方法。CRISPR-Cas9作为20世纪90年代初发现的基因编辑技术,目前仍然是一项非常新颖的核心技术,除了存在“脱靶”的主要问题外,还有许多的技术难点尚未突破,尤其是临床应用的靶向性、有效性和安全性依然是科学家关注和争论的焦点。下面就一起来了解慢病毒载体和CRISPR/Cas9基因编辑技术的结合是如何应用于疾病治疗的基础研究。
案例1——慢病毒&癌细胞精准杀伤
i‑CRISPR: a personalized cancer therapy strategy through cutting cancer‑specific mutations
作者单位:海军军医大学
IF:41.44
研究提出的“i-CRISPR”策略,就是根据癌细胞的DNA序列,定制且导入仅能切割癌细胞DNA的CRISPR-Cas9系统——“癌细胞CRISPR剪刀”,造成癌细胞中DNA断裂;同时添加DNA损伤修复抑制剂(DNA damage repair inhibitor, DSBRi),使癌细胞中断裂的DNA无法修复,导致细胞死亡。DNA损伤修复抑制剂就是“i-CIRSPR”策略中的“i”,切割癌细胞DNA的“癌细胞CRISPR剪刀”就是“i-CIRSPR”策略中的“CRISPR”。由于正常细胞中不含有可被“癌细胞CRISPR剪刀”切割的位点,因此其DNA不会被切割,也不会受到严重损伤。如此,这种“i-CRISPR”策略有望实现既能特异性杀伤癌细胞又不会对正常细胞造成明显损伤的效果,该策略为肿瘤的精准治疗提供了新的治疗思路。
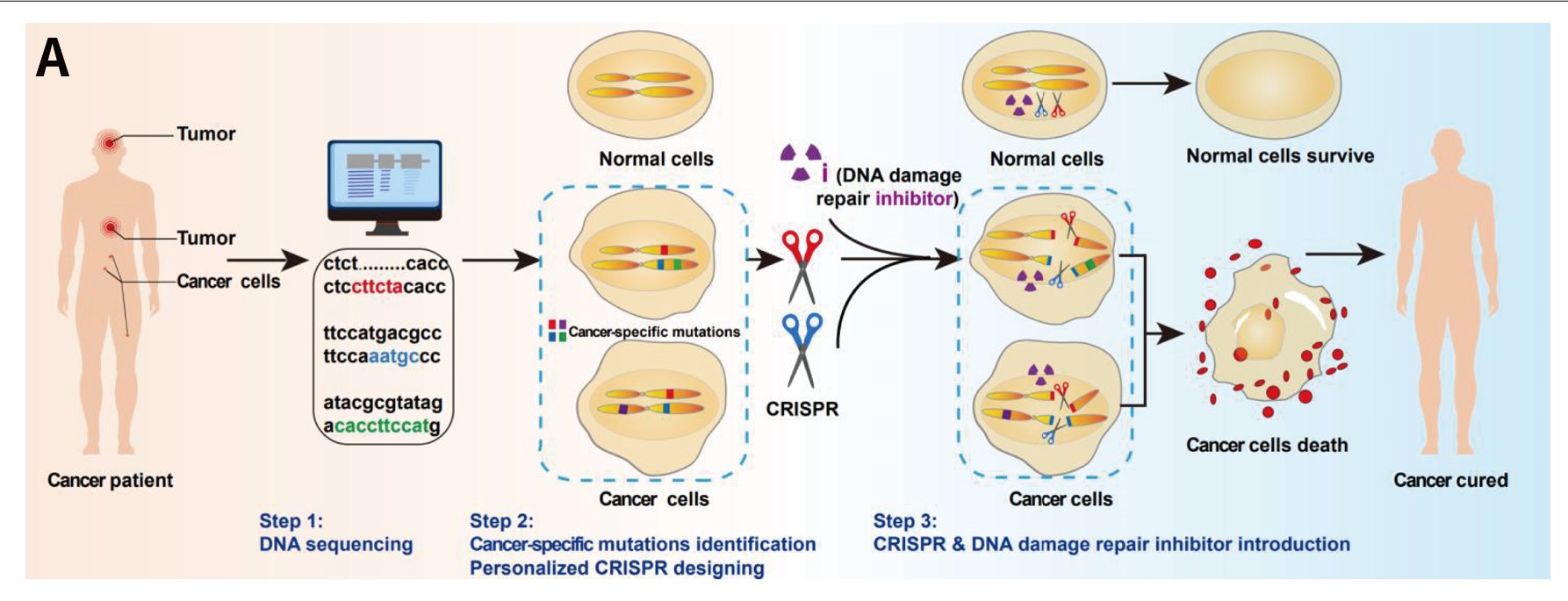
★模型种类:HepG2(肝癌)细胞和DU145(前列腺癌)细胞、类器官、PDX模型
和元生物有幸提供实验中使用的病毒包装服务
案例2——慢病毒&高效包装Cas9/sgRNA
Delivering Cas9/sgRNA ribonucleoprotein (RNP) by lentiviral capsid-based bionanoparticles for efficient ‘hit-and-run’ genome editing
CRISPR/Cas9机制的瞬时表达不仅可降低脱靶活性导致的突变风险,还可降低对Cas9蛋白可能产生的免疫应答。该研究开发的一种系统,通过适配子和适配子结合蛋白(ABP)之间的特异性相互作用,可以在每个慢病毒样颗粒(LVLP)中包装多达100个拷贝的Cas9 mRNA,在此基础上开发了一种基于慢病毒衣壳的生物纳米颗粒系统,可以高效包装Cas9/sgRNA核糖核蛋白(RNP)。我们的研究表明,用com适配子取代sgRNA支架的Tetra-loop保留了sgRNA的功能,并且com-修饰的sgRNA可以通过ABP与适配子、sgRNA与Cas9蛋白之间的特异性相互作用,将Cas9/sgRNA RNP包装成慢病毒样颗粒。这些RNP纳米粒子在不同细胞的不同靶点上产生了插入缺失,其效率与Cas9 mRNA LVLPs相似或更好。Cas9/sgRNA RNP系统作用快速、脱靶率较低,并使递送更方便和高效,可用于Cas9瞬时表达和高效的基因组编辑。

★细胞类型:人类淋巴母细胞
和元生物可提供本文所涉及的Cas9/sgRNA及慢病毒包装服务
案例3——慢病毒&体内靶向递送
Systemic delivery of CRISPR/Cas9 to hepatic tumors for cancer treatment using altered tropism of lentiviral vector
由于缺乏有效的体内递送载体,CRISPR/Cas9核酸酶的治疗应用仍然是一个挑战。本文评估了用丙型肝炎病毒(HCV)/E1E2包膜糖蛋白改造的假型慢病毒载体系统在体内递送CRISPR/Cas9到肝肿瘤的能力。研究表明E1E2假型慢病毒载体可以通过其与细胞受体之间的特异性相互作用选择性地将针对蛋白纺丝蛋白(KSP)的Cas9和sgRNA递送到小鼠的原位Huh7肿瘤中。这种特定的递送导致KSP基因的有效断裂,抑制肿瘤生长。此外,研究证明了E1E2假型慢病毒载体因其在人血清中稳定、细胞靶向特异性强、固有免疫反应低的特点,更适合作为CRISPR/Cas9的递送系统,用于癌症治疗。

★小鼠品系:Balb/c裸鼠(4周龄,雌性)
和元生物可提供本文所涉及的靶基因sgRNA设计及慢病毒包装服务
案例4——外泌体&体内靶向递送
Exosome-mediated delivery of Cas9 ribonucleoprotein complexes for tissue-specific gene therapy of liver diseases
CRISPR-Cas9基因编辑技术已成为一种强大的治疗技术,但缺乏安全高效的体内递送系统,尤其是组织特异性载体,限制了其在临床中的广泛应用。Cas9核糖核蛋白(RNP)的体内递送具有一定优势,然而,较大的Cas9 RNP超出了目前可用的递送载体的装载能力。本研究开发了一种新的基因组编辑递送系统,命名为外泌体-RNP,该系统通过电穿孔将Cas9 RNP装载到从肝星状细胞分离纯化的外泌体中。在体外,外泌体-RNP促进了RNP有效的胞质递送,而在体内则特异性地聚集在肝组织中。外泌体-RNP通过分别靶向p53上调凋亡调节因子(PUMA)、细胞周期蛋白E1 (CcnE1)和K(赖氨酸)乙酰转移酶5 (KAT5)等分子,在急性肝损伤、慢性肝纤维化和肝癌小鼠模型中显示出强大的治疗潜力。外泌体-RNP为肝脏疾病的精准组织特异性基因治疗提供了可行的平台。
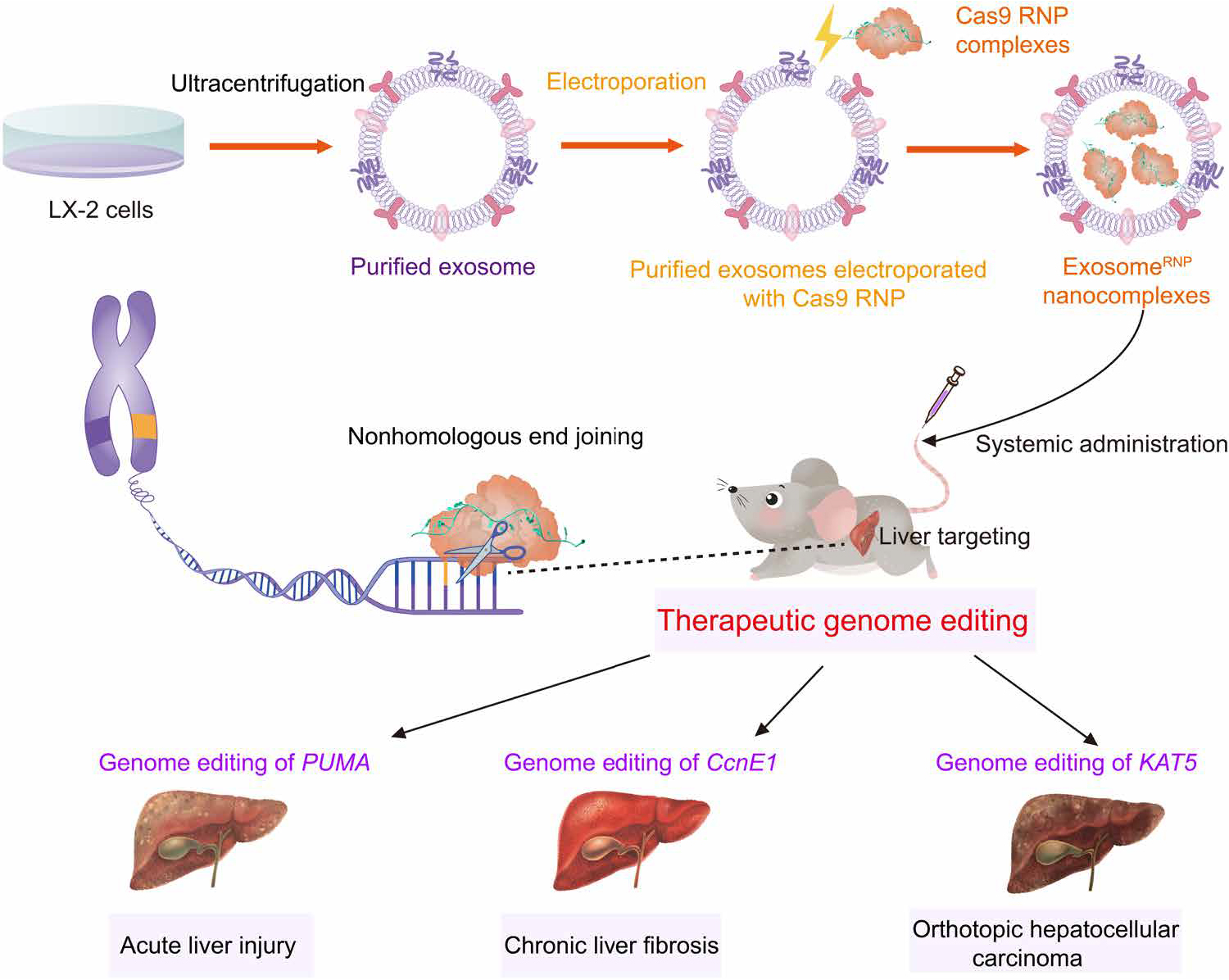
和元生物可提供本文所涉及的外泌体及CRISPR-Cas9技术相关的服务
和元生物肿瘤研究整体或定制化服务
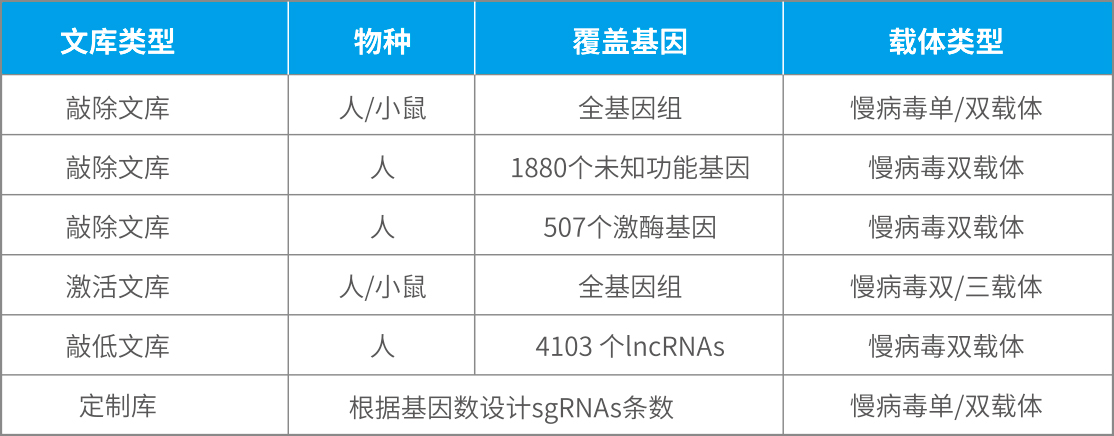
和元生物常用文库列表
和元生物一直致力于病毒载体的研制服务,拥有10万+的病毒包装经验/4.6万+病毒载体库,包装GMP级别的病毒质粒。和元生物拥有多种慢病毒包装系统:三质粒/四质粒包装系统。
涵盖过表达/干扰、CRISPR/Cas9、Cumate诱导表达系统、Tet-on/off系统、Cre-loxp系统等专属您的定制慢病毒,同时也涵盖CRISPR/Cas9敲除或激活文库、自噬单标或双标、萤光素酶现货慢病毒产品。
结合和元生物自主研发获批专利的Vpack慢病毒包装系统,能够攻克病毒不出毒和滴度低的问题,能保证lncRNA表达更精确,载体荧光表达更亮,病毒出毒更稳定。GMP级别的病毒质粒可以全面满足您在体内、体外对基因编辑的安全性要求,让您在基因调控的道路上无后顾之忧。
感恩回馈,突破底价


扫一扫,反馈当前页面
和元生物