
Neuron | 拯救星星之子!上科大管吉松组揭示ASH1L单倍不足致小鼠自闭症的神经机制
组蛋白甲基转移酶被确认为许多神经发育障碍的风险基因。Ash1l是一种组蛋白甲基转移酶,属于三胸家族(trxG)蛋白的成员之一,其能拮抗多梳蛋白家族对基因转录的抑制功能。目前越来越多的研究证明,Ash1l基因功能缺失是自闭症谱系障碍(autism spectrum disorder, ASD)发生的首要危险因素,然而,关于Ash1l单倍体不足导致与 ASD相关致病机制尚不清楚。

结果
前脑神经元Ash1l单倍体不足导致小鼠的ASD样表型
首先,作者比较了Ash1l+/-小鼠[1,2]和WT小鼠的行为学表型,在Ash1l+/-小鼠中检测到了单倍体不足,同时,旷场实验(the open-field test)和埋珠实验(the marble-burying test)行为学范式结果显示,Ash1l+/-小鼠表现类似焦虑、重复刻板的行为(图1A,B)。此外,对出生后7-9天(P7-P9)小鼠进行幼鼠超声发声测试,发现Ash1l+/-小鼠在生命早期存在现沟通障碍的现象(图1C)。三箱社交实验(three-chamber assay)结果显示Ash1l+/-小鼠也表现出社交障碍(图1D)。这些结果提示了Ash1l突变小鼠表现出典型的自闭症样行为,包括沟通困难,重复刻板行为、社交障碍等。
单细胞基因表达分析发现,在中枢神经系统中, Ash1l优先在神经元中表达(图1E)。因此,研究人员借助原位杂交链式反应(HCR-FISH)做进一步验证,发现在皮层神经元中,Ash1l阳性信号与Map2阳性信号((Map2+,神经元标志物)高度重叠(图1F);在Map2-细胞中,Ash1l信号点数量明显减少。这提示了神经元中Ash1l功能缺失可能导致自闭症谱系障碍 (Autism Spectrum Disorder, ASD)样行为。
基于上述结果,作者构建Ash1lEmx1-cKO小鼠(特异性在前脑,特别是新皮层和海马区敲除Ash1l,图1G-I),并通过行为学范式发现,前脑Ash1l单倍体不足导致小鼠ASD样行为(图1J-L)。
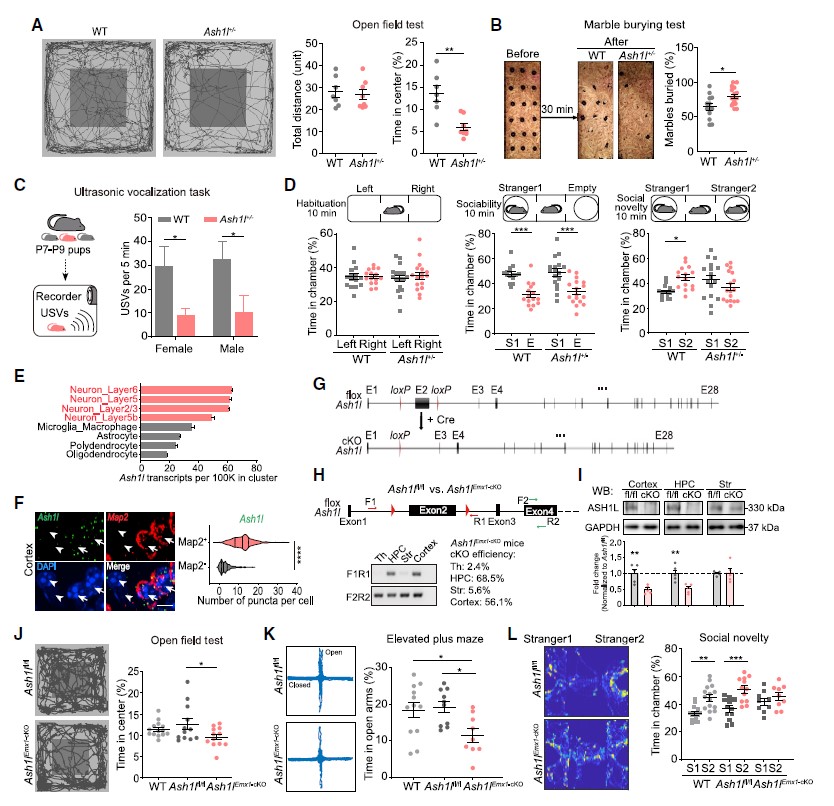
图1 Ash1l单倍体不足导致小鼠的ASD样表型
Ash1l突变小鼠存在辨别能力缺陷
接下来,研究人员对Ash1l缺失小鼠的学习行为进行评估,借助条件性恐惧反射范式发现,Ash1l+/-小鼠和WT小鼠均学会了情境性恐惧条件反射,并表现出类似的恐惧记忆重提水平,然而Ash1l+/-小鼠在恐惧学习的第三天表现出木僵行为(freezing, 老鼠的一种防御反应)下降;此外,在Ash1l+/-小鼠中未观察到两种不同环境下的木僵行为差异(WT小鼠在context A中表现出较高的木僵行为,在context B(新环境)中表现出较低的木僵行为),提示了Ash1l+/-小鼠辨别能力受损(图2A,B)。
在音调依赖的辨别范式(图2C-E)和基于音调的Go-No-go行为范式(图2F-H)中,Ash1l+/-小鼠同样表现出明显的听觉辨别障碍(听觉脑干反应(ABR)测试Ash1l+/-小鼠无明显的听力损失)。
为了验证前脑神经元中Ash1l缺失是否会导致与Ash1l+/-小鼠类似的辨别能力障碍现象,作者借助Ash1lEmx1-cKO小鼠进行相关行为学范式,发现Ash1lEmx1-cKO小鼠与恐惧记忆相关的听觉辨别能力明显受损(图2J,K)。这种Ash1l突变小鼠的辨别能力异常符合部分ASD患者的临床表现。前脑Ash1l缺失可导致突触和神经环路功能障碍,以及辨别行为障碍。
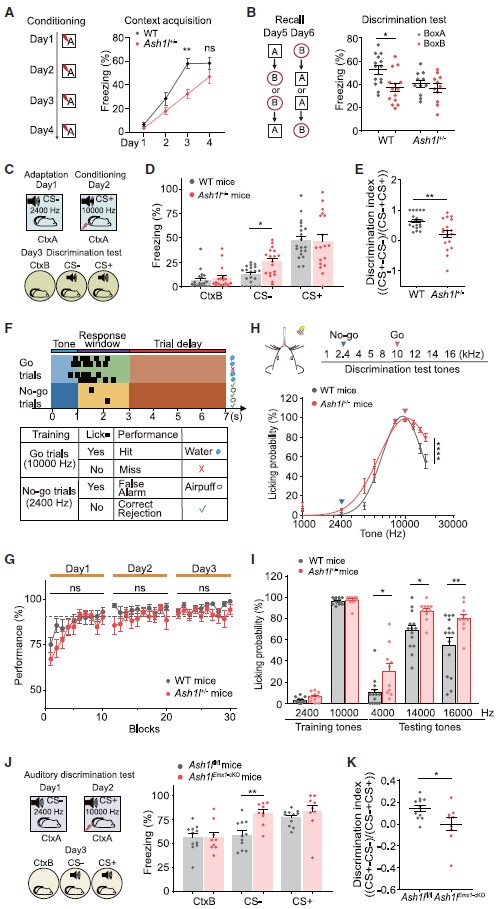
图2 Ash1l+/-小鼠表现出正常的学习能力,但辨别能力受损
Ash1l以细胞自主效应的方式介导活动依赖的突触修剪过程
随后,作者借助高尔基染色发现,1月龄的Ash1l+/-小鼠皮层神经元和背侧纹状体中棘神经元(MSNs)的树突棘密度显著增加(图3A),为研究这种现象是否源于突触消除过程(synapse elimination)的减少,研究人员研究了Ash1+/-小鼠原代皮层神经元的突触密度变化。用表达ChR2光敏蛋白的慢病毒载体(Lenti-CaMKIIa-ChR2)感染培养的神经元,并用LED刺激(图3B),发现WT神经元在LED刺激后24h树突突触素(SYP)密度显著降低,而Ash1l+/-组则未观察到这种现象(图3C,D),提示了Ash1l可能介导了活动依赖的突触修剪过程。活体成像结果显示,Ash1l+/-组培养的神经元中,活性依赖的突触消除过程被削弱。
此外,作者还研究了在小鼠新皮层中活性依赖的突触消除,追踪了听觉皮层(auditory cortex, AUD)到后顶叶皮层(posterior parietal cortex, PTLp)长距离投射轴突的变化。研究人员将AAV-EF1a-DIO-EYFP注射在Rbp4-Cre小鼠AUD,特异性标记听觉皮层L5神经元(图3H)。小鼠接受音调依赖的恐惧条件训练,成像观察轴突变化发现,声调依赖的恐惧条件学习24h后,Ash1l+/-::Rbp4-Cre小鼠“bouton”(突触小结)的清除明显低于WT小鼠,而“bouton”形成则保持不变(图3H-J)。
为探究这种“突触修剪”过程的缺失是否由Ash1l缺失神经元的细胞自主效应导致的,研究人员将AAV-hSyn-Cre和AAV-EF1a-DIO-EYFP注射于Ash1lfl/fl小鼠右侧AUD区(图3K),对小鼠进行音调依赖的恐惧条件行为学范式训练,在学习之后借助体内成像技术追踪突触的变化,发现Ash1l缺失的神经元中学习依赖的突触的增加数量没有发生改变,而学习诱发的突触的减少数量显著低于正常小鼠(图3K-M)。这些数据提示了Ash1l以细胞自主效应的方式介导皮层神经元的活动依赖的突触修剪过程。
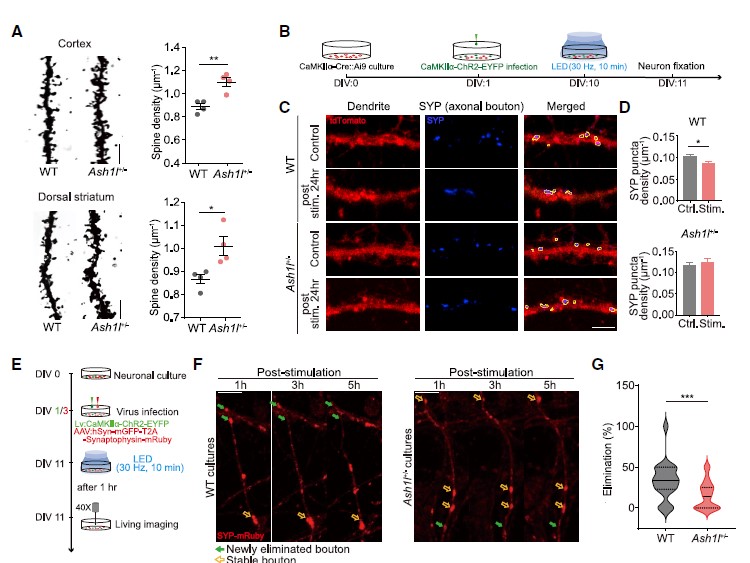
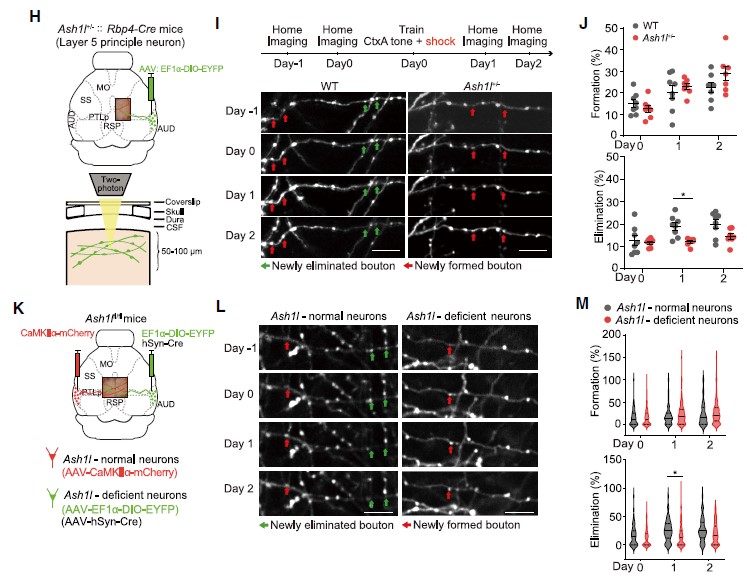
图3 Ash1l以细胞自主效应的方式介导活动依赖的突触修剪过程
Ash1l调控幼鼠和成年小鼠中EphA7的表达
随后,研究人员借助音调依赖的恐惧条件行为学范式,在体内/体外均发现Ash1l+/-小鼠听觉皮层活动依赖的神经元中EphA7表达远低于WT小鼠的(图4D-I),提示了在Ash1l+/-小鼠中EphA7活动诱导表达受损。
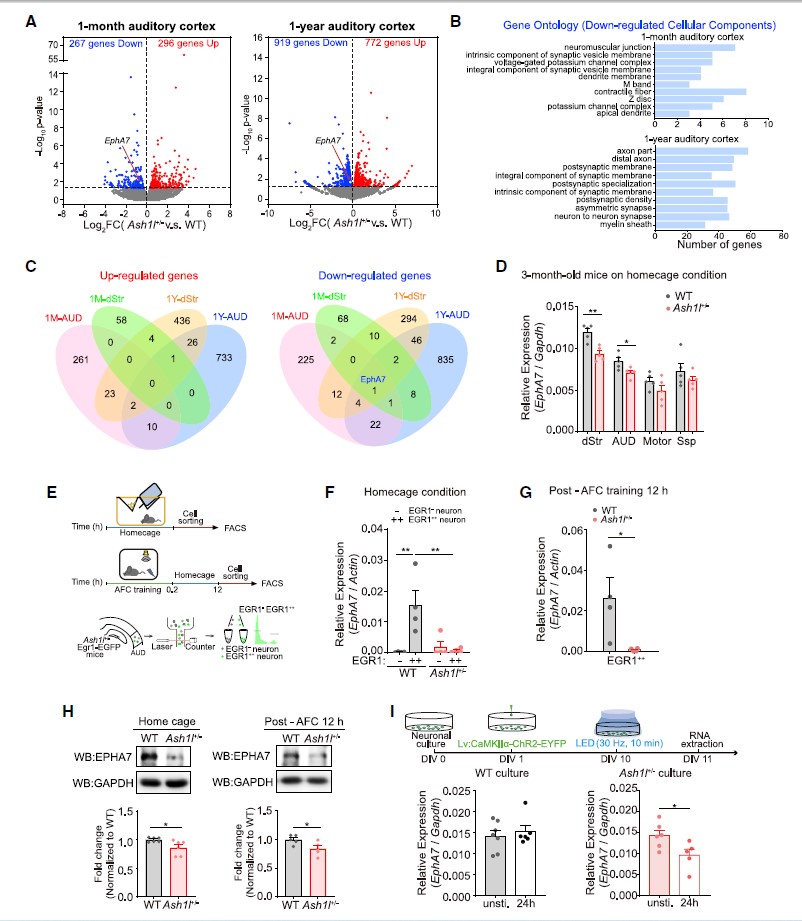
图4 Ash1l调控幼鼠和成年小鼠中EphA7的表达
Ash1l通过拮抗EZH2-H3K27me3来调控EphA7的表达
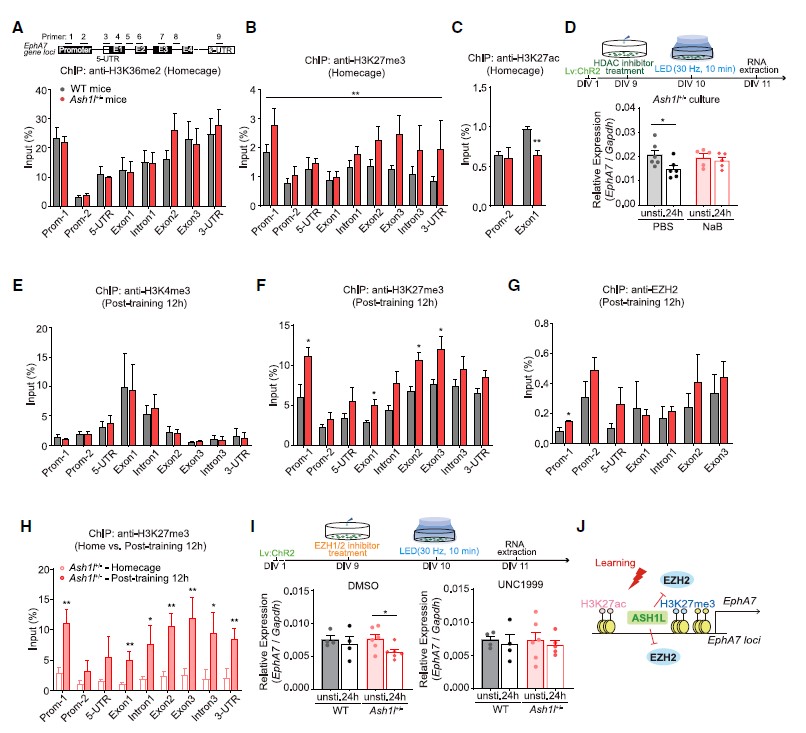
图5 Ash1l通过拮抗EZH2-H3K27me3沉默来调控EphA7的表达
EphA7高表达可改善Ash1l+/-小鼠突触修剪过程缺陷和行为异常
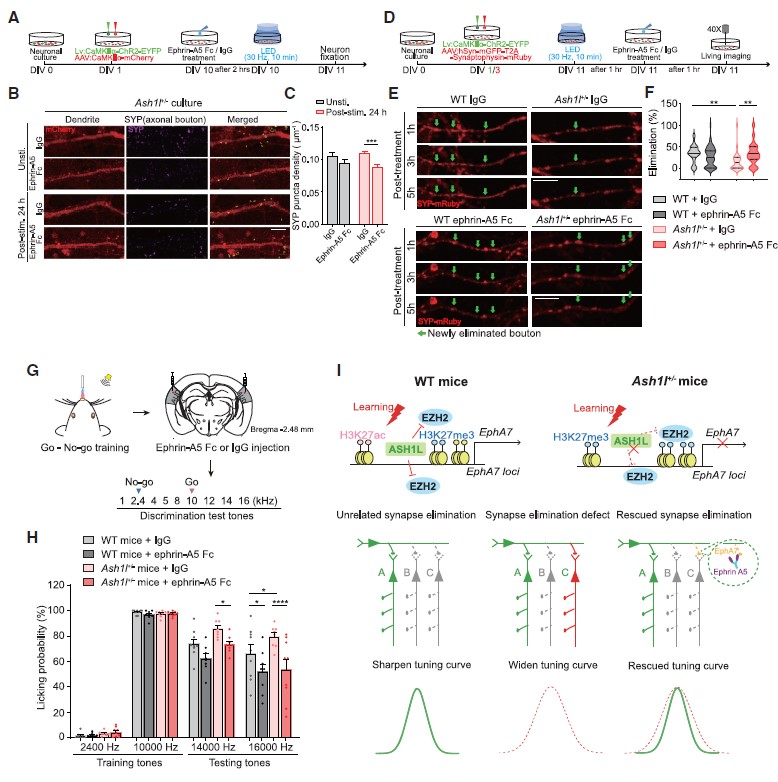
图6 Ephrin-A5激活EphA7高表达Ash1l+/-小鼠突触修剪过程缺陷和行为异常
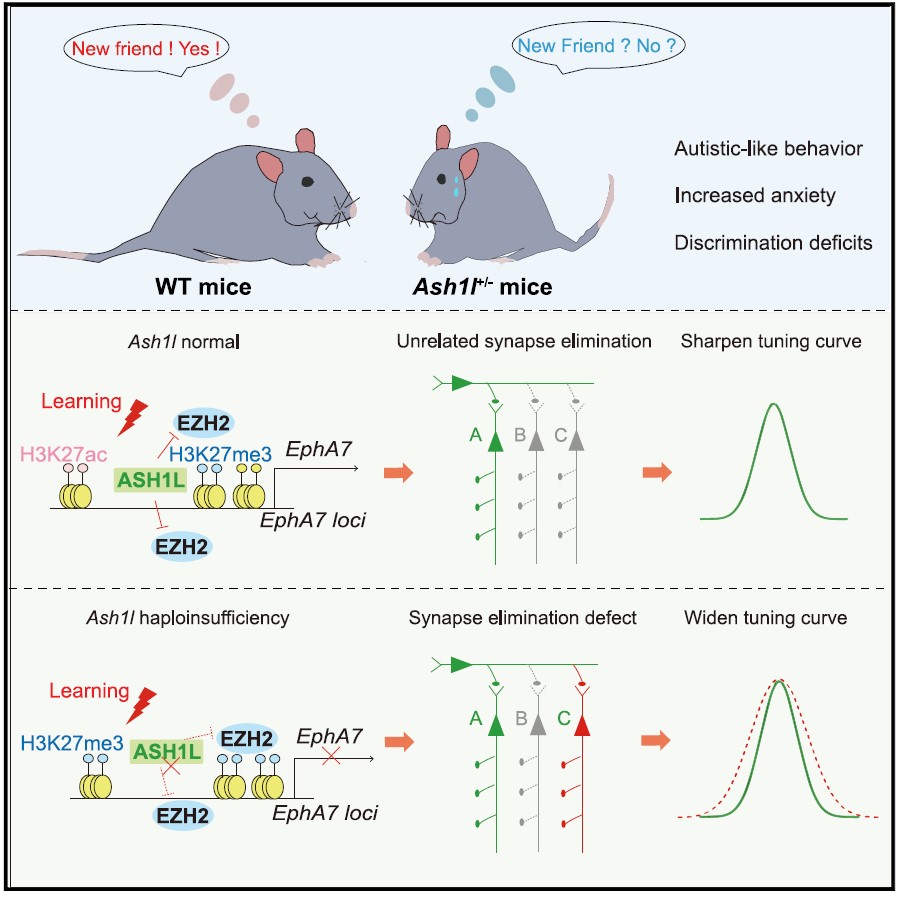
结论
作者介绍及基金信息
该研究受到科技部科技创新2030-重大项目资助,和自然科学基金项目以及上海市科委项目支持。
业务咨询

原文链接:
https://www.cell.com/neuron/fulltext/S0896-6273(21)01090-4
可复制查看
参考文献
[1] Liu, S.G., Tian, M.M., He, F., Li, J.N., Xie, H., Liu, W.M., Zhang, Y.T., Zhang, R., Yi, M.J.,Che, F.Y., et al. (2020). Mutations in ASH1L confer susceptibility to Tourette syndrome. Mol Psychiatr 25, 476-490.
[2] Zhu, T., Liang, C., Li, D., Tian, M., Liu, S., Gao, G., and Guan, J.S. (2016). Histone methyltransferase Ash1L mediates activity-dependent repression of neurexin-1alpha. Sci Rep 6, 26597.
[3] Beuter, S., Ardi, Z., Horovitz, O., Wuchter, J., Keller, S., Saha, R., Tripathi, K., Anunu, R., Kehat, O., Kriebel, M., et al. (2016). Receptor tyrosine kinase EphA7 is required for interneuron connectivity at specific subcellular compartments of granule cells. Sci Rep 6,1451 29710.
[4] Nguyen, T.M., Arthur, A., Zannettino, A.C.W., and Gronthos, S. (2017). EphA5 and EphA7 forward signaling enhances human hematopoietic stem and progenitor cell maintenance,migration, and adhesion via Rac 1 activation. Exp Hematol 48, 72-78.
[5] Clifford, M.A., Athar, W., Leonard, C.E., Russo, A., Sampognaro, P.J., Van der Goes, M.S., Burton, D.A., Zhao, X.M., Lalchandani, R.R., Sahin, M., et al. (2014b). EphA7 signaling guides cortical dendritic development and spine maturation. P Natl Acad Sci USA 111, 4994-4999.
[6] Depaepe, V., Suarez-Gonzalez, N., Dufour, A., Passante, L., Gorski, J.A., Jones, K.R., Ledent, C., and Vanderhaeghen, P. (2005). Ephrin signalling controls brain size by regulating apoptosis of neural progenitors. Nature 435, 1244-1250.

扫一扫,反馈当前页面
和元生物