在肿瘤发展过程中,细胞进入循环系统的能力是重要的研究对象。相关的信号通路主要可以分为控制细胞黏附和控制细胞骨架。细胞的迁移与侵袭主要与细胞骨架和黏附相关。肿瘤细胞侵袭和迁移能力的改变通常采用Transwell进行检测。细胞划痕也是测定肿瘤细胞运动特性的方法,由于无法区别正常增殖和迁移细胞,应用有局限性。
Transwell实验
Transwell小室底层的一张有通透性的膜(一般为聚碳酸酯膜),将其放置于孔板中,小室内称上室,培养板内称下室。由于聚碳酸酯膜有通透性,下层培养液中的成分可以影响到上室内的细胞。应用Transwell可研究下层培养液中的成分对细胞生长、运动等的影响。
肿瘤迁移实验:研究肿瘤细胞的迁移能力或特定情况下肿瘤细胞的迁移能力。常用8.0、12.0µm膜,上室种肿瘤细胞,下室加入FBS或某些特定的趋化因子,肿瘤细胞会向营养成分高的下室跑,计数进入下室的细胞量可反映肿瘤细胞的迁移能力。
肿瘤侵袭实验:研究肿瘤细胞的侵袭能力或特定情况下肿瘤细胞的侵袭能力。在聚碳酸酯膜上涂上一层基质胶,模仿细胞外基质,上室种肿瘤细胞,下室加入FBS或某些特定的趋化因子,细胞要把基质消化后才可以从上室迁移到下室,计数进入下室的细胞量测定细胞的侵袭能力。
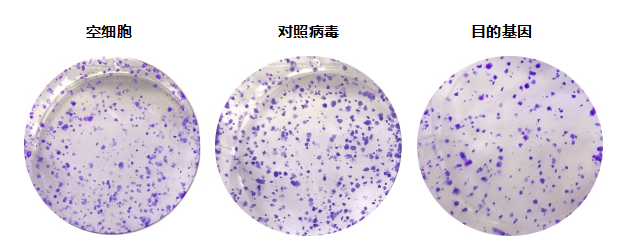
目的: 研究目的基因过表达/干扰对细胞侵袭、转移能力的影响
材料:正常细胞、对照慢病毒、过表达基因慢病毒
步骤:细胞复苏——Transwell铺板——细胞培养及染色——拍照
结果:
划痕实验原理
肿瘤细胞在体外仍具有迁移的能力。细胞划痕法是测定了肿瘤细胞的运动特性的方法之一。其借鉴体外细胞致伤愈合实验模型,在体外培养的单层细胞上,划痕致伤,然后比较不同实验组中肿瘤细胞迁移的能力。
目的: 使用筛选的稳定株(转对照病毒、过表达基因病毒),通过对空细胞、对照稳转、目的基因稳转三组细胞进行划痕宽度进行统计学分析,研究基因对细胞迁移能力的影响。
材料:病毒和细胞株,目的细胞来源于客户,稳定株和元构建
步骤:细胞铺板——划线——细胞培养及拍照——统计分析
结果:

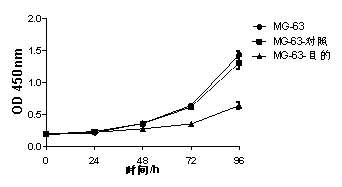
 细胞增殖
细胞增殖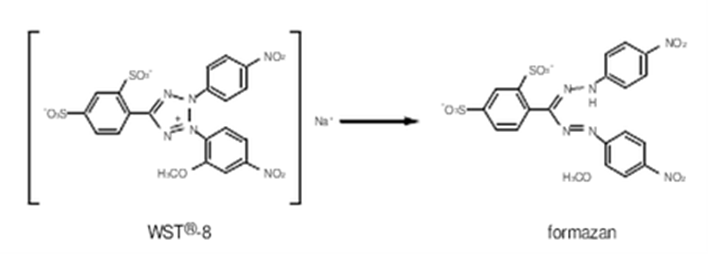
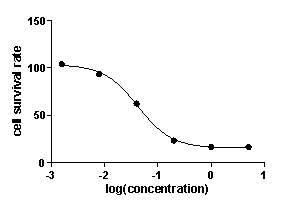
 细胞凋亡
细胞凋亡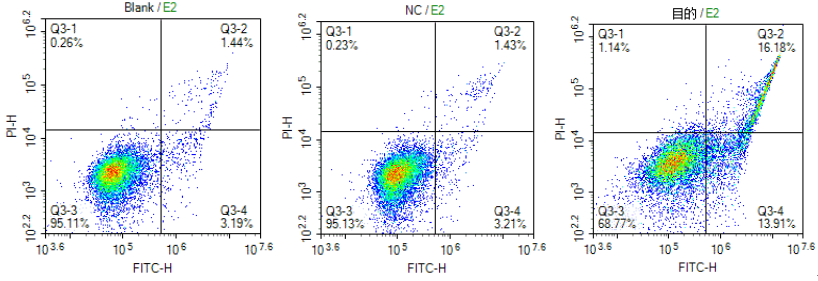
 细胞侵袭和迁移
细胞侵袭和迁移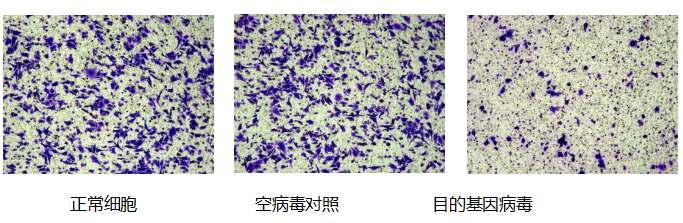

 细胞周期检测
细胞周期检测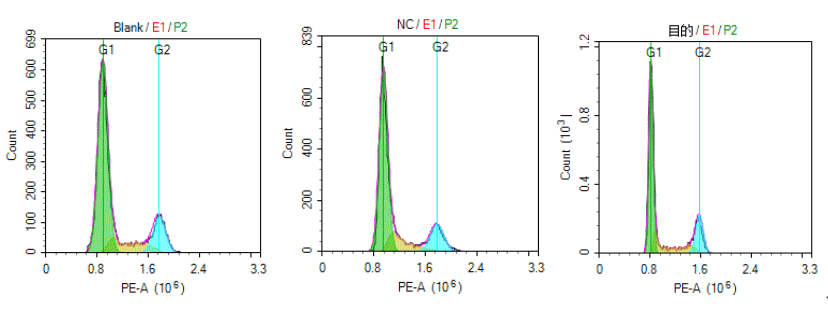
 克隆形成实验
克隆形成实验