从20世纪70年代起,基因工程技术的发明带动了基因传输、获取和编辑等与基因疗法密切相关的关键技术的开发,一些重要的基因工程技术如基因载体技术、基因克隆技术、基因编辑技术等给现代基因疗法技术带来了深刻的影响。
上篇中,为大家介绍了基因疗法的发展历程以及国内对该领域的发展布局;以下,继续将对目前基因疗法领域的技术发展以及现行的相关法规政策进行一个大致的概述。
基因疗法技术的不断突破
目前,基因疗法领域最热门的技术可以说是AAV载体递送技术、CRISPR基因编辑技术、单/双碱基编辑技术以及溶瘤病毒基因改造技术等。
(1)腺相关病毒(AAV)载体技术
腺相关病毒(AAV)最早于在
20世纪60年代中期从实验室腺病毒(AdV)制剂中发现,随后很快就在人体组织中被发现。它具有无致病性、高效的长期基因表达、易于基因操作以及免疫反应低(或在许多情况下缺乏)的特点,这一系列特性使其成为基因递送的重要工具。
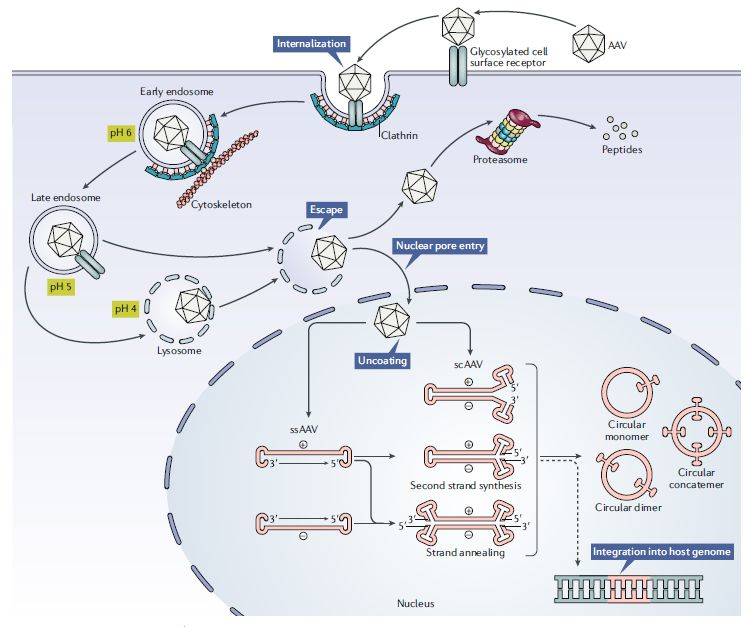
▲重组AAV载体介导转基因表达的过程
目前,
前沿的AAV基因组设计能够将衣壳中携带的单链DNA设计成自我互补的序列。这种序列的优点在于它不需要单链DNA复制成为双链DNA的步骤就可以进行转录,与传统的单链AAV基因组相比,它的基因表达更为迅速,而且表达量更高。诺华公司开发的治疗脊髓性肌肉萎缩症(SMA)的Zolgensma就使用了这种基因组设计。然而这种设计的一个缺点是AAV携带的转基因容量减半,还需要进一步研究优化。
至今为止,
全球已有三款以重组AAV为载体的基因治疗药物获批上市,除了诺华公司的Zolgensma(AAV9)以外,另外两款是UniQure公司开发的Glybera(AAV1)和SparkTherapeutics公司开发的Luxturna(AAV2);另外还有一款治疗A型血友病的AAV基因治疗药物BMN-270(来自BioMarin)也提交了上市申请。由此我们可以看出AAV基因疗法的潜力是巨大的。
(2)CRISPR基因编辑技术
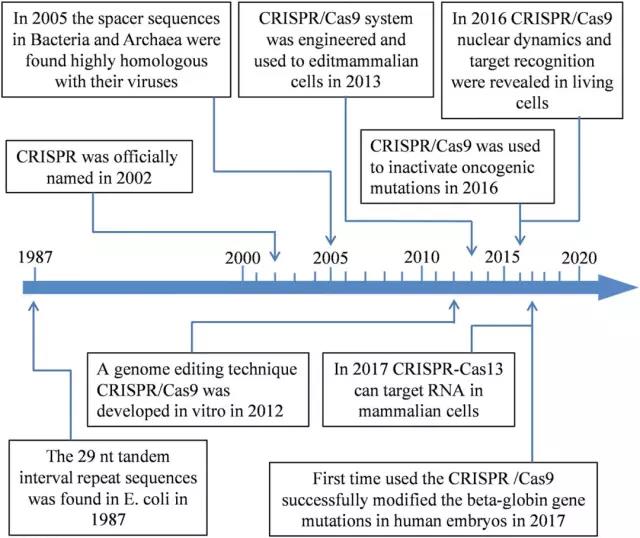
作为基因编辑工具,CRISPR已经成为生物医学领域的最热门技术。早在20世纪下半叶,CRISPR序列就已经被科研人员发现并记录 ,直到2002年,这些序列正式被命名为:规律间隔成簇短回文重复序列(Clustered Regularly Interspaced Short Palindromic Repeats, CRISPR)。
▲ CRISPR技术发展时间轴(图片来源:Nature)
2012年8月,Doudna与Charpentier两个团队合作在Science杂志发表了关于利用CRISPR/Cas系统在体外对DNA进行精确切割的具有开拓性的研究论文:他们可以使用这种CRISPR/Cas9系统
在任何想要的地方切割任何基因组。
随后,取得进一步进展的是麻省理工学院(MIT)和哈佛大学的Broad研究所的华人学者张峰,其研究组于2013年2月刊登的一篇论文表明:CRISPR/Cas9可用于编辑小鼠细胞或人类癌细胞的基因组。在同一期的Science期刊上,哈佛大学的
George Church和他的团队展示了如何使用CRISPR技术来编辑不同的人体细胞,包括正常人的iPS细胞。
从那时起,研究人员发现CRISPR/Cas9的功能非常多样。科学家不仅可以使用CRISPR通过剪断基因来“沉默”基因,还可以利用修复模板将剪切片段留下的缝隙替换为所需的基因。
随后,科学家们对CRISPR技术进行了多方面的改进研究,截止2017年,关于CRISPR的论文,就已经有
超过14,000篇。目前,该技术发展的相当成熟,已经广泛运用于基因疗法领域,有望帮助各类遗传性基因疾病患者获得新的治疗途径。
(3)单/双碱基编辑技术
现有的基因编辑技术,例如CRISPR、ZFN、TALEN,通过在DNA中产生靶向的双链断裂,然后依靠细胞自身修复机制来完成编辑过程;这些方法可以有效地改变基因表达。然而,
它们缺乏对编辑结果的控制,脱靶效应以及对DNA双链断裂的依赖,可能导致基因编辑后的细胞出现不可预期的混乱。许多基因组突变发生在单个碱基中,为使基因编辑更加精确,
单碱基基因编辑技术应运而生,旨在针对这些单一的碱基错误(即点突变),而不会在DNA中造成双链断裂。
2016年4月,David Liu教授团队在Nature上发表的论文表示,首次
开发出了胞嘧啶碱基编辑器(CBE),能够在不依赖DNA双链断裂的情况下首次实现了对单个碱基的定向修改。
这便开启了CRISPR系统的单基因编辑时代。随后,David Liu教授团队又开发了
另一种单碱基基因编辑工具——腺嘌呤碱基编辑器(ABE),从此研究人员首次实现了不依赖于DNA断裂而能够
将DNA四种碱基A、T、G、C进行替换的单碱基基因编辑技术。
但科学家们在随后的研究过程中发现,单碱基编辑系统存在严重的脱靶效应,同时会诱导大量基因突变,另外还存在着编辑窗口单一、编辑转化效率不高等缺点,故而对其展开了一系列的优化改善研究;
2019年10月,David Liu团队再次开发出
先导编辑器(Prime Editor, PE),一种能够搜索和替换(碱基)的基因编辑器,在不依赖DSB和供体DNA的条件下便可有效
实现所有12种碱基转换(C→T、G→A、A→G、T→C、C→A、C→G、G→C、G→T、A→C、A→T、T→A和T→G),此外还能有效实现多碱基的精准插入。
2020年6月,国内邦耀生物与华东师范大学刘明耀教授及李大力教授团队合作的一项研究表明,将胞嘧啶脱氨酶hAID-腺嘌呤脱氨酶-Cas9n(SpCas9 D10A突变体)融合在一起,开发出的一种
新型双功能碱基编辑器-命名为:A&C-BEmax,不仅可以实现单独的C>T或A>G,还可以在同一等位基因上同时实现C>T和A>G的高效转换。双碱基基因编辑技术的出现极大地丰富了碱基编辑工具、扩展了碱基编辑器的应用范围,为遗传病治疗、作物育种等于带来新的发展,可以说是人类在基因编辑领域新的突破。
(4)溶瘤病毒基因改造技术
溶瘤病毒(Oncolytic Virus, OV)是一类能选择性感染和杀伤肿瘤细胞的病毒,具有特异性复制能力,并能激发机体产生抗肿瘤免疫反应。它们的作用原理主要是
通过对自然界存在的一些致病力较弱的病毒进行基因改造制成特殊的溶瘤病毒,利用靶细胞中抑癌基因的失活或缺陷从而选择性地感染肿瘤细胞,在其内大量复制并最终摧毁肿瘤细胞。
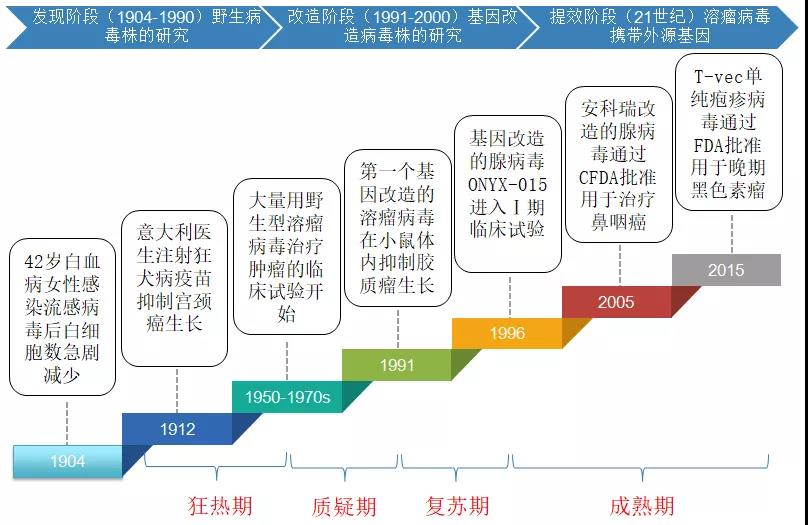
▲ 溶瘤病毒发展史
溶瘤病毒疗法最初发现于20世纪初期,活跃于20世纪中期的大量临床试验,但由于当时技术有限,主要都是利用天然的溶瘤病毒,其引发的强烈免疫反应和并发症导致效果不佳、副作用大,使得当时化疗和放疗显示出了颠覆性的疗效,故而该领域受到冷落。
后来,随着病毒学和基因工程技术的不断发展,使得人们能对病毒基因进行改造,这大大提高了溶瘤病毒在肿瘤治疗方面的效果、特异性和安全性。之后,溶瘤病毒就开启了肿瘤治疗的新纪元——溶瘤病毒疗法。
随着重组病毒基因组改造技术的逐渐成熟,溶瘤病毒疗法技术已广泛运用于实践。
其里程碑事件,是2015年美国FDA和欧盟批准溶瘤病毒T-Vec上市;目前T-Vec已在美国、欧洲和澳大利亚广泛用于复发黑色素瘤治疗。近几年,该领域似乎重新回归到大家的视野中,成为国内外基因疗法研发领域的星星之火,值得期待。
基因疗法监管机制的发展
基因治疗监管政策于1993年首次出台,由国家科学技术委员会颁布的“基因工程安全管理措施”为起步进行推行。随后在不断发展中,21世纪初,中国形成了相对全面但仍然宽松的基因治疗监管政策,涉及药物临床试验、基因治疗质量控制、辅助生殖、伦理审查、干细胞等多方面管控。
2010年,国家食品药品监督管理局发布了《药品临床试验伦理审查指导原则》。2015年,国家食品药品监督管理局与国家卫生和计划生育委员会联合发布了监管措施和道德准则,例如干细胞临床研究管理措施(试行),质量控制和治疗指导原则。同年,国家卫计委取消了对第三类医疗技术临床应用的行政审批,因此细胞疗法和基因疗法可以由医疗机构自行批准。
但在2016年,我国发生了关于生物免疫疗法的“魏则西事件”之后,国家卫计委立即暂停了所有未经批准的第三类医疗技术的临床应用,并且对基因治疗领域采取了更严格的监管政策。
尽管如此,基因疗法作为一种新的生物医疗技术和医学产业,仍然属于国家重点发展的领域。随后,国务院在“十三五”国家战略性新兴产业发展规划(国发[2016] 67号)中,对基因治疗领域的产业发展制定了激励政策。但是当时,中国尚未就人类基因技术问题(包括基因治疗)形成一套全面而系统的法律法规体系。
2018年,受贺建奎的“CRISPR基因编辑婴儿事件”影响,中国开始加强生物安全,基因技术和生物医学等领域的立法。2019年,《生物安全法》通过了全国人民代表大会常务委员会的第一次审查。该法律的目标是成为生物安全的基础、系统、全面和主导的基本法。
2019年,在中央全面深化改革第九次会议上,审议通过了《国家科技伦理委员会组建方案》,目的是建立全面覆盖、秩序协调、标准化的综合科学技术伦理治理体系。目前,国家卫计委正在采取相应的立法行动,并起草了《生物医学新技术临床应用管理条例》(征求意见稿)》和《生物技术研究开发安全管理条例(征求意见稿)》,目标是形成更加合理的监督机制,以便生物技术研发、应用和相关产业健康发展。
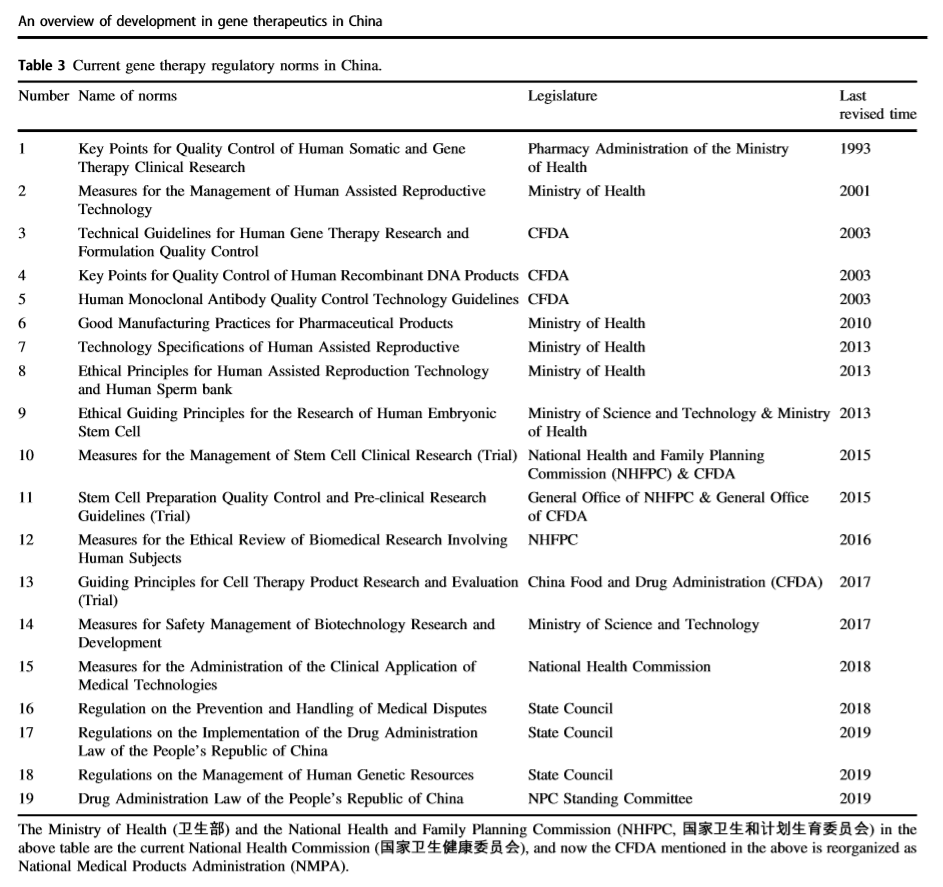
由此,我国基本形成了与基因疗法技术以及行业发展相适应相协调的全面监管政策。
▲ 中国现行的基因治疗监管规范
展望
近年来,我国基因疗法领域正在逐步兴起。作为一种新的医学领域,它正在深刻地改变着制药业的面貌,但还并未发展成熟,对此人类还需要进行更长时间的探索和发现。
尽管如此,这并不可怕。“泡泡男孩”的基因疗法事件告诫我们,相比于恐惧,在学习中探索未知,才会使基因疗法领域得到蓬勃发展,才能使得更多患者获得生的希望。
因此,公众对该领域的认可、国家社会对该领域的支持、相关法律法规的建树,都将会成为该领域新疗法诞生的关键推力。
和元生物将持续专注于基因治疗CDMO服务,助力基因治疗造福人类。基于公司基因和细胞治疗载体CDMO平台可提供从非注册临床研究用质粒和病毒生产(IIT)、基因治疗新药临床申报整体方案(IND)到基因治疗临床样品及商业化GMP生产的整体服务,服务产品包括基因和细胞治疗用质粒、腺相关病毒、慢病毒、腺病毒、多种溶瘤病毒以及基因疫苗等新型基因载体。
参考资料:
1.An overview of development in gene therapeutics in China
关于和元生物

01 非注册临床研究用质粒和病毒生产
在符合GMP管理体系的中试车间完成质粒和病毒生产,并提供所有产品的质量检验报告,用于在医院开展研究者发起的临床研究。
02 基因治疗新药临床申报整体方案
提供可用于中、美新药临床试验申请的临床前中试样品生产服务, 根据开发的实验室规模工艺进行中试放大,生产过程严格按照GMP要求进行,中试样品用于申报IND,并撰写全套双语CMC材料。中试过程由经验丰富的生物制药工程师负责,并由实验室工艺开发研究员负责技术转移。
主要涉及:
-
工艺研究和质量研究
-
连续批次中试生产和稳定性研究
-
质粒和病毒全套申报CMC材料
03 基因治疗临床样品及商业化GMP生产
GMP生产平台用于生产临床级的重组病毒药物,总投资过亿元人民币。研发生产总面积约10000m2,包括动力中心、 洁净工程、WFI系统、仓库、质粒生产车间、病毒生产车间、质控实验室、灌装车间等。平台采用一次性生产技术进行质粒和病毒的生产,由GE医疗提供灵活工厂(FlexFactoryTM),其余辅助设备均采用国际优质品牌。
基于该平台,和元生物将为基因治疗和细胞治疗药物研发企业提供高质量的病毒载体CDMO服务:
-
原材料入库检验及放行
-
GMP原材料供应商审计
-
技术转移、工艺开发及放大
-
制剂、方法学开发及验证
-
质量保证体系全流程管理
-
10L、50L、100L一次性反应器大肠杆菌发酵质粒生产
-
100L、200L、500L一次性反应器细胞培养病毒生产
-
GMP液体制剂灌装
-
短期及长期稳定性研究等
04 其他服务
-
GMP液体制剂灌装服务
-
动物药效学研究
-
注射用水
-
质量控制咨询与检测
-
临床样本检测等