最近科研界什么比较流行?
外泌体(Exosomes)是当之无愧的热点话题。不论在肿瘤领域、神经科学领域还是代谢领域,都有大量的外泌体相关文章发表,以探究外泌体的功能和机制。
再梳理一下外泌体的基本知识。外泌体是一类大小为30-150nm、呈茶托状的由脂质双层膜包裹的细胞外囊泡,广泛存在于细胞培养上清及各种体液中,包括血液、淋巴液、唾液、尿液、卵泡液、精液、心包液、乳汁等。外泌体内含有多种蛋白质(如TSG101、HSP70等)、核酸(DNA、RNA)和脂质(胆固醇、鞘磷脂等),这些内容物因释放外泌体的细胞不同而有比较大的差异。
外泌体首先需要从样本中分离出来,目前比较公认的分离方法是超速离心法,再通过透射电镜(TEM)、纳米粒径跟踪分析(NTA)、Western Blot等进行鉴定。获得外泌体后,对外泌体进行标记,观察外泌体被摄取情况,再进一步探索外泌体的功能,如组织修复、肿瘤转移、代谢重建等。下面我们仔细聊一聊外泌体标记的方法:
一、亲脂性染料标记:
目前已发表的外泌体文章中,外泌体大多使用亲脂性染料进行标记,体内和体外都较多应用。亲脂性染料主要分为两大类,一类是PKH67(绿色荧光)/PKH26(红色荧光),由于它们可以与外泌体的脂质双层膜稳定结合,所以染色效果较好,应用较广泛。
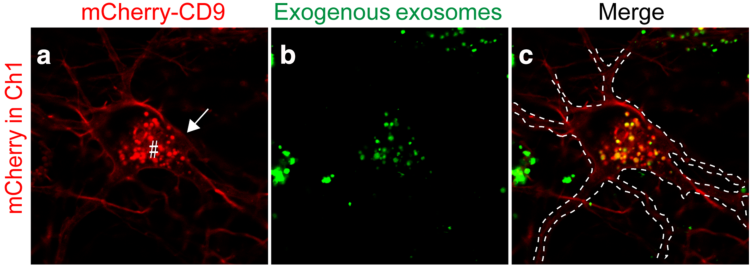
图一 PKH67标记的外泌体与神经元之间相互作用
ActaNeuropatholCommun. 2018 Feb 15;6(1):10.
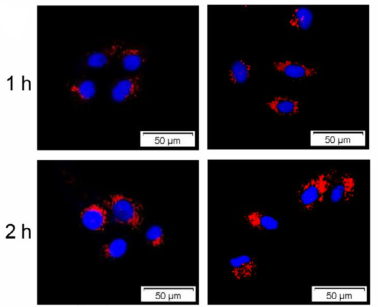
图二 PKH26标记的外泌体与MDA‐MB‐231细胞共培养
Cancer Sci. 2019 Oct;110(10):3173-3182.
二类是Di系列的亲脂性染料,包括DiI(橙色荧光)、DiO(绿色荧光)、DiD(红色荧光)、DiR(深红色荧光)。其中DiR的红外荧光可穿透细胞和组织,在活体成像中用来示踪。
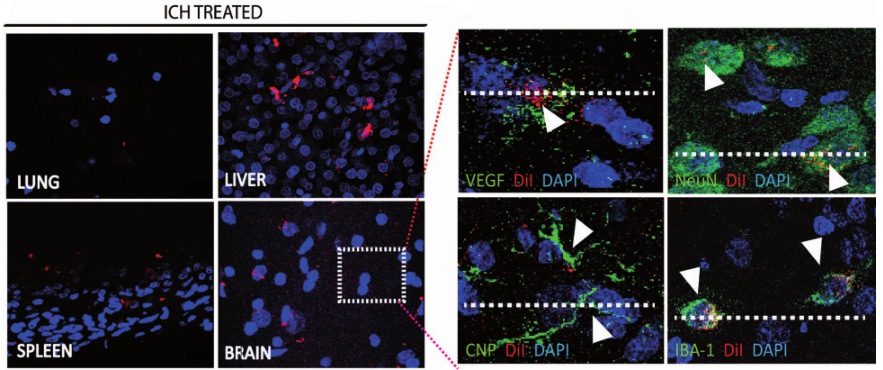
图三DiI标记的外泌体通过静脉注射观察在体内器官的分布情况
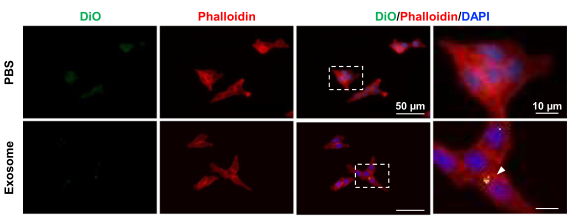
图四 DiO标记的外泌体与HCT116细胞共孵育
图五DiR标记的外泌体再尾静脉注射小鼠结肠癌肿瘤模型
J Nanobiotechnology. 2020 Jan 9;18(1):10.
二、慢病毒介导CD63-GFP表达:
将外泌体的特定蛋白CD63和绿色荧光蛋白GFP的表达元件构建成质粒再包装到慢病毒中,随后用此慢病毒感染细胞,使细胞分泌的外泌体带有绿色荧光。
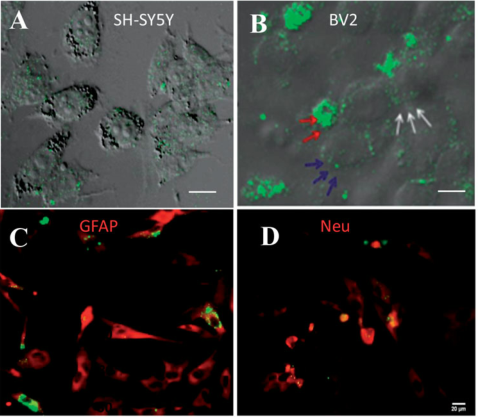
图六 用GFP标记的外泌体分别与SH-SY5Y、BV2和DRG细胞共培养
Artif Cells NanomedBiotechnol. 2019 Dec;47(1):2918-2929.
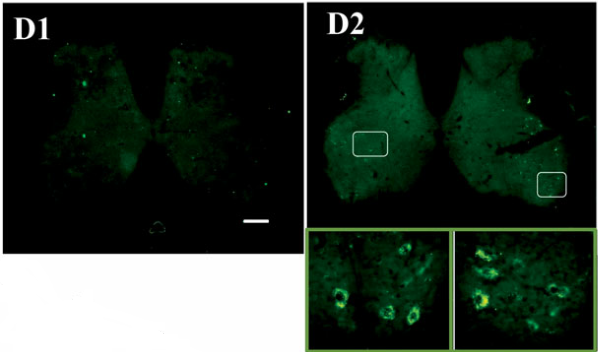
图七 注射有CD63-GFP的外泌体后观察第1天(D1)和第5天(D2)的荧光
Artif Cells NanomedBiotechnol. 2019 Dec;47(1):2918-2929.
三、用金纳米颗粒(gold nanoparticles,GNPs)标记:
将金颗粒标记的外泌体通过鼻内给药不仅能进行无创跟踪,而且能促进外泌体在脑部的积累和延长在病变区域的存在时间,增强体内神经成像的效果。因此,这种外泌体标记技术可以作为多种脑疾病的强大诊断工具,并可能增强基于外泌体的神经恢复治疗。
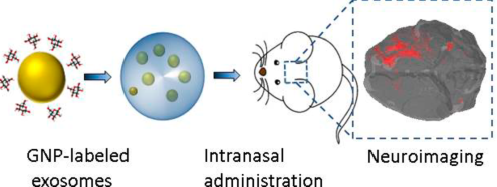
图八 金纳米颗粒外泌体的制备及体内注射
ACS Nano. 2017 Nov 28;11(11):10883-10893.
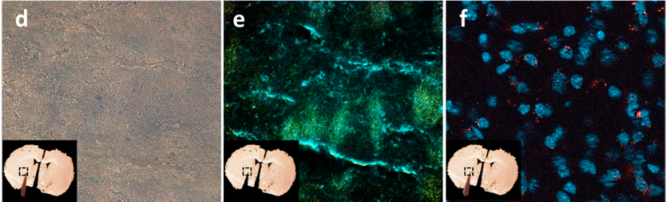
图九用金颗粒和PKH26对外泌体进行双标记
ACS Nano. 2017 Nov 28;11(11):10883-10893.
四、用近红外(NIR)荧光探针进行标记:
这是一种使用两亲性探针对NIR荧光标记的外泌体进行内源性检测的方法,无需对外泌体进行免疫标记或合成或色谱处理。由于NIR波长的荧光探针能穿透体内组织,从而提供了从细胞直接转换到体内使用的好处。
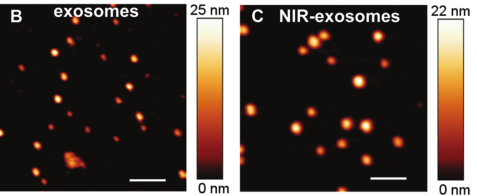
图十 未标记外泌体和NIR标记外泌体的原子力显微镜图片
ChemCommun (Camb). 2018 Jun 26;54(52):7219-7222.
五、用Gaussia luciferase(gluc)和截断的lactadherin进行标记:
将gLuc-lactadherin构成融合表达的质粒,再将此质粒转染细胞,使细胞分泌的外泌体带有强的萤光素酶活性。将标记的外泌体进行静脉注射入小鼠体内,看外泌体在组织的分布情况。
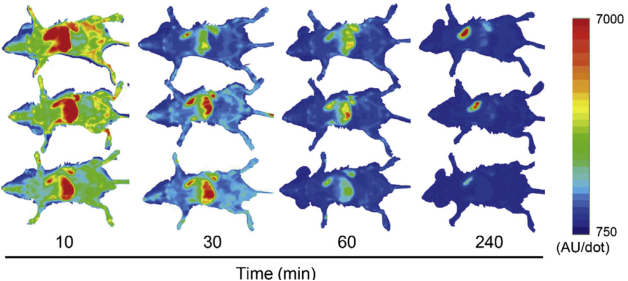
J Biotechnol. 2013 May 20;165(2):77-84.
文章总结:
外泌体标记对探究外泌体的功能是必不可少的一个步骤,首先需要观察到外泌体被受体细胞吸收或到达目的组织、器官,再检测受体细胞、组织或器官中相应指标的变化,看外泌体是否具有一定的功能。确定外泌体具有功能后,再通过高通量测序或基因芯片进行差异表达分子的挖掘,进一步深入研究机制。