
高歌猛进:BioMarin发布针对A型血友病基因治疗的4年积极临床数据
BioMarin公司近日更新发布旗下针对A型血友病的基因治疗疗法valoctocogene roxaparvovec(BMN 270)临床I/II期试验的四年追踪数据,数据显示该药物在治疗开始四年后仍继续安全、有效地预防出血。此次披露的研究结果已提交给将于6月14日至19日举行World Federation of Hemophilia (WFH) Virtual Summit会议。

BioMarin的此项基因治疗疗法使用人为改造的5型腺相关病毒(AAV5),通过患者血液直接注射,在患者体内表达凝血因子VIII的部分功能序列(hFVIII-SQ基因),为A型血友病患者提供凝血因子VIII。
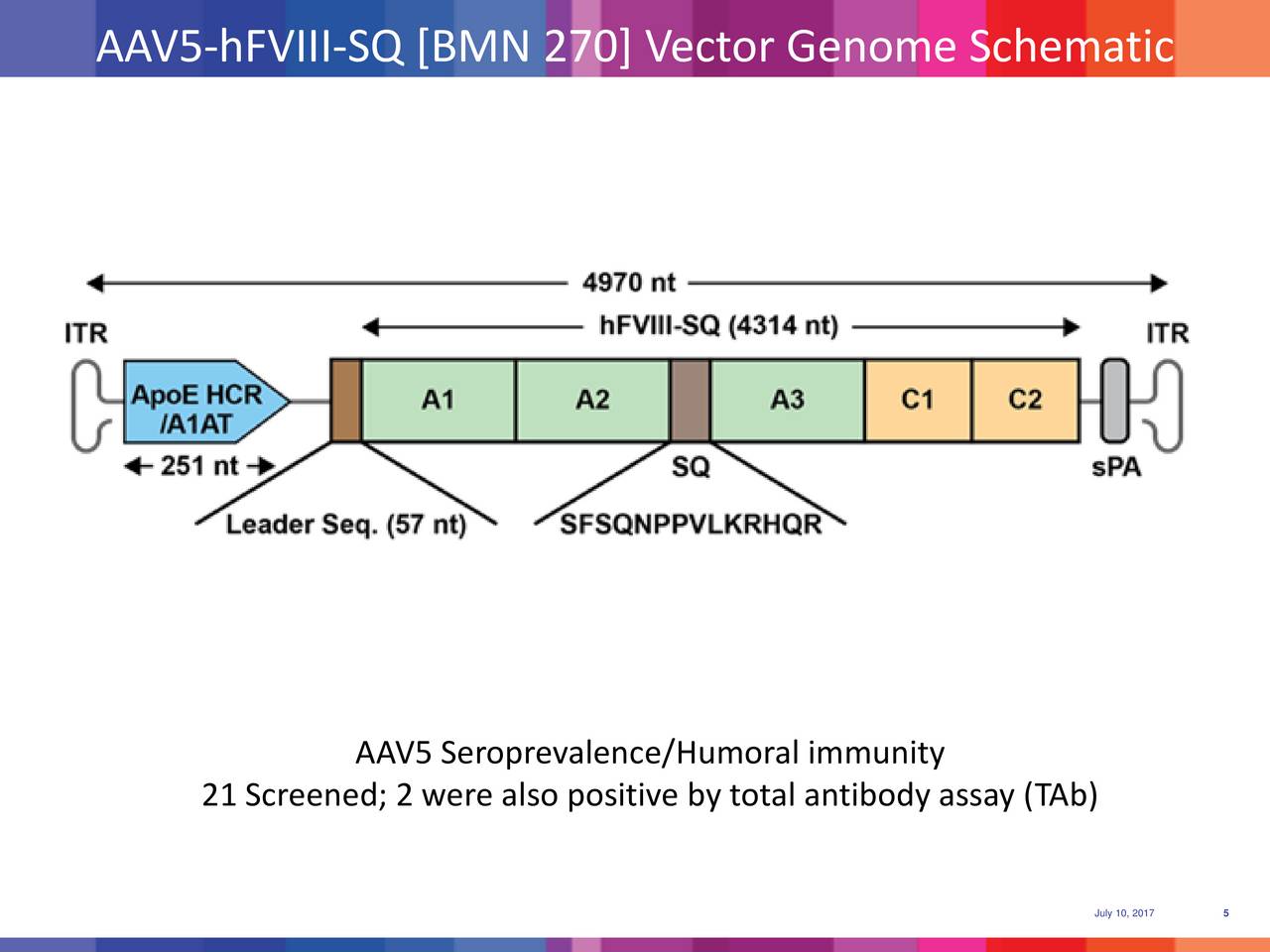
该临床试验的首席研究员、Barts and the London School of Medicine and Dentistry大学教授John Pasi博士表示,此次得到的临床试验数据标志着成功开发首个治疗A型血友病的基因疗法迈出重要一步。逐年累积的临床数据都增加了人们对该疗法安全性和有效性的认识,并为基因治疗(尤其是针对A型血友病)提供了越来越多的科学数据。

正在进行的I/II期临床试验(NCT02576795)正在评估四种不同剂量的BMN 270对15名患有严重A型血友病的成年男性5年内的安全性和有效性。

此前披露的三年数据显示,极低剂量组(AAV使用量:6*10^12和2*10^13 vg/kg体重)的两位受试成年男性患者治疗三年后仍然有低水平的VIII因子,并仍在持续监测中。相比之下,其余受试的13位成年男性患者(6位给予4*10^13 vg/kg剂量,7名给予6*10^13 vg/kg剂量)显示凝血因子VIII的水平有临床意义的升高,平均年化出血率(ABR)显著下降,同时并不需要进行凝血因子VIII的辅助预防性治疗。
此次发布的数据包括6*10^13 vg/kg剂量组(高剂量组)的4年临床数据更新和4*10^13 vg/kg剂量组(低剂量组)的3年临床数据更新。结果显示,所有受试患者均继续不需要接受凝血因子VIII的预防性治疗,他们的平均ABR仍维持在较低水平(高剂量组为1.3,低剂量组为0.5,明显低于治疗前的比率)。
在过去一年中,接受高剂量治疗的6名男子(86%)和接受低剂量治疗的5名男子(83%)均未发生出血事件。受试者的凝血因子VIII活性水平随年龄成比例下降,但仍继续处于治疗范围内。
该疗法的安全性与之前报道的一致,没有新的不良事件发生,也没有受试从研究中退出。没有一名参与者出现因子VIII抑制剂或血栓事件。根据之前的数据,该疗法最常见的治疗相关不良事件常发生在治疗后早期,包括短暂的输液相关反应,以及短暂的、无症状的、轻度到中度的某些肝蛋白水平的升高。
BMN 270基因疗法目前正在接受美国FDA的优先审查,并接受欧洲药物管理局(EMA)的加速评估,以快速推进该药物的临床使用。如果获得批准,它将以Roctavian的品牌名称上市。

BMN 270疗法曾获得FDA的突破性治疗指定,以及EMA的优先药物(PRIME)指定。它还被两个监管机构授予孤儿药指定。BioMarin对于BMN 270在美国和欧盟的申请都是基于I/II期临床试验三年数据和正在进行的临床III期GENEr8-1试验(NCT03370913)。BioMarin预计将在2021年第一季度公布GENEr8-1试验的一年数据。
针对该基因治疗的PDUFA的日期已经确定为2020年8月21日(即在此时间前FDA必须对报批药物给与生物制剂许可证申请的审评意见);在欧洲,BioMarin预计到今年年底或2021年初或得到人类药物使用委员会(CHMP)的评审意见,CHMP是EMA的一个分支机构。对此,BioMarin全球研发总裁Hank Fuchs 博士表示,BioMarin很自豪能够提高了社会对于基因治疗改变生命的认识,在开展临床试验后的短短四年内,BioMarin即开始提交全球范围的基因治疗药物上市申请,并将继续推进治疗A型血友病的基因疗法,搜集更多数据以改善血友病患者生活质量。
BioMarin近期获得了EMA针对其基因治疗产品的生产和质量体系的cGMP认证,爱尔兰卫生产品监管局(HPRA)在今年第一季度代表EMA进行了预批准检查,并在第二季度颁发了cGMP认证。FDA对该工厂的检查预计将在第二季度完成,这将使该工厂在美国获得与8月21日PDUFA日期一致的潜在许可。

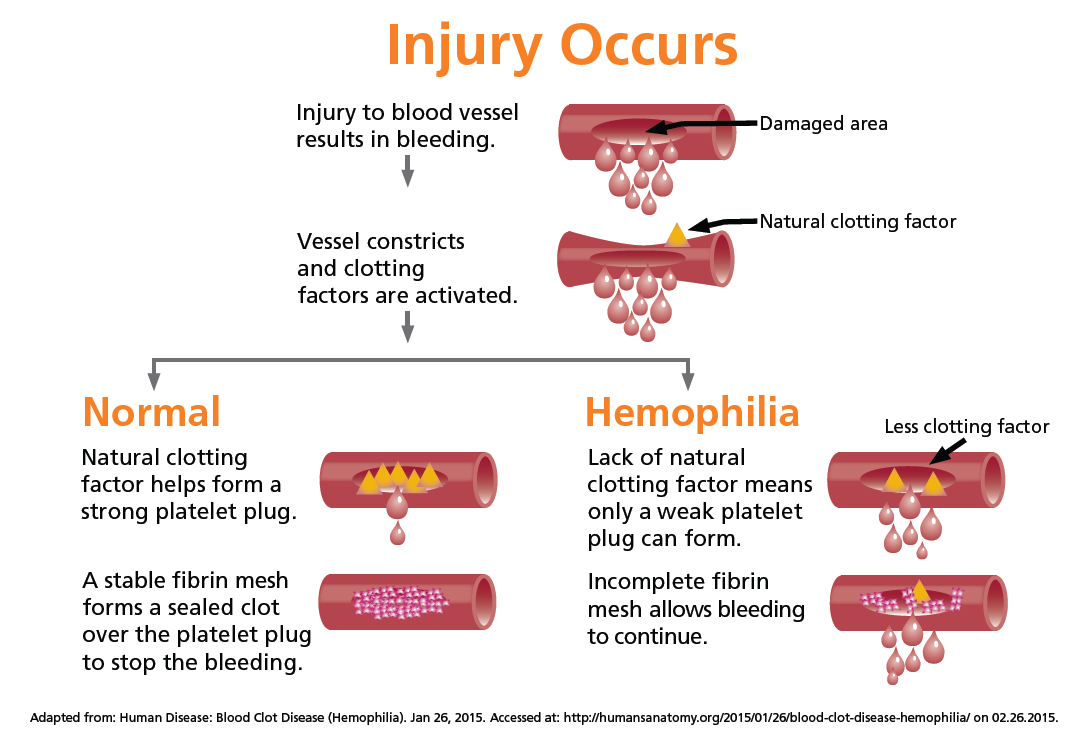
血友病为一组遗传性凝血功能障碍的出血性疾病,其共同的特征是活性凝血活酶生成障碍,凝血时间延长,终身具有轻微创伤后出血倾向,重症患者没有明显外伤也可发生“自发性”出血,危及生命。2018年5月11日,国家卫生健康委员会等5部门联合制定了《第一批罕见病目录》,血友病被收录其中。

市场分析数据表明,到2026年,整个血友病医疗的市场价值预计将达到168.4亿美元,同时,A型血友病占血友病病例的80%,严重的A型血友病患者约占所有A型血友病患者的45%,因此,治疗严重A型血友病的疗法将有广阔的市场空间。
根据目前的规则,严重A型血友病是指患者的凝血因子水平<1%,这些患者在很多情况下会无缘无故地自发流血,危及生命。现存治疗血友病的方法即预防性补充凝血因子VIII,从而通过输液的方式帮助患者凝血功能恢复,然而不幸的是,严重A型血友病患者对这些治疗没有响应,且持续发生出血事件。
BioMarin是一家全球性的生物技术公司,致力于为患有严重且危及生命的罕见和超罕见基因疾病的患者开发创新疗法并将其商业化,该公司的产品管线涵盖六个商业化产品和多个临床和临床前候选产品。

作为一家新型基因和细胞治疗产业化CDMO服务公司,和元生物 可提供非注册临床研究用质粒和病毒生产、基因治疗新药临床申报整体方案、基因治疗临床样品及商业化GMP生产等服务,涉及产品包括基因和细胞治疗用质粒、慢病毒、腺相关病毒、溶瘤病毒、新型基因疫苗等,同时欢迎基于外泌体的药物开发合作。
以“基因药·中国造”为使命,助力基因治疗造福人类的伟大愿景。


扫一扫,反馈当前页面
和元生物