
【Nature】吸烟、手机、游戏上瘾,你缘何无法戒除它们?
吸烟有害健康,手机影响视力,游戏耽误学习,大道理我们谁都懂。可是,为什么我们总是身不由己的趋向这些自己拼命想要戒除的事物呢?要想知其所以然,还需究其根本,晓其机制。只有不乱阵脚,明辨敌情,方能克敌于千里之外。
说起成瘾,其重要表现之一即是强迫性。如同强迫症患者一样,即使反复考虑到事后直拍大腿的后悔情绪,我们也总是情不自禁地点燃香烟,拿起手机,开始游戏。那么,其内因究竟如何呢?
神经生物学方面大量研究表明,这些成瘾性物质均作用于中脑多巴胺系统,引起快乐分子多巴胺的释放[1, 2]。此外,眶额叶皮层(OFC)与背侧纹状体(DS)也扮演重要角色。抑制OFC显著减少可卡因的自给药行为[3],抑制DS减少惩罚条件下小鼠对可卡因的寻找行为[4]。
尽管多方面线索均指向OFC与DS为成瘾行为的核心,但究其如何调控成瘾者对目标铤而走险的渴求,也就是成瘾行为的强迫性,我们尚未可知。
2018年12月19日,《Nature》杂志刊登了瑞士日内瓦大学C. Lüscher教授的最新重要工作[5],他们发现OFC到DS产生大量兴奋性投射,改变OFC-DS环路的突触可塑性可双向调控成瘾行为的强迫性。该研究首次发现突触可塑性对成瘾行为强迫性的调控,极大提高了人们对成瘾行为的认知。
结果
1.惩戒条件下小鼠成瘾行为的强迫性
过去研究表明,瘾君子药物成瘾的表征之一即中脑多巴胺释放水平提高。于是,作者使用光遗传多巴胺神经元自刺激(optogenetic dopamineneuron self-stimulation, oDASS)作为研究成瘾的行为学范式,此方法可模拟药物成瘾范式[3, 6]。
他们在DAT-Cre小鼠的腹侧被盖区(VTA)注射AAV-DIO-ChR2,并埋植光纤。小鼠按压活性杆5秒后可触发 30串20Hz蓝光刺激光激活多巴胺神经元,12天可建立oDASS模型(图1a-b)。
建立oDASS模型后,作者通过电刺激(500ms,0.25mA)惩罚小鼠以研究成瘾的强迫性,此刺激强度可阻断糖水成瘾自给药行为[3]。他们发现在第4次惩罚阶段中,根据行为学表现可将小鼠分为两组,第一组在电刺激惩罚条件下依然坚持oDASS,我们称之为坚持者小鼠;第二组在电刺激惩罚条件下大幅减少oDASS,我们称之为放弃者小鼠,坚持者和放弃者小鼠的比率与性别无关(图1c-f)。
后续实验中,作者以惩戒条件下oDASS作为成瘾行为强迫性的行为学表征。
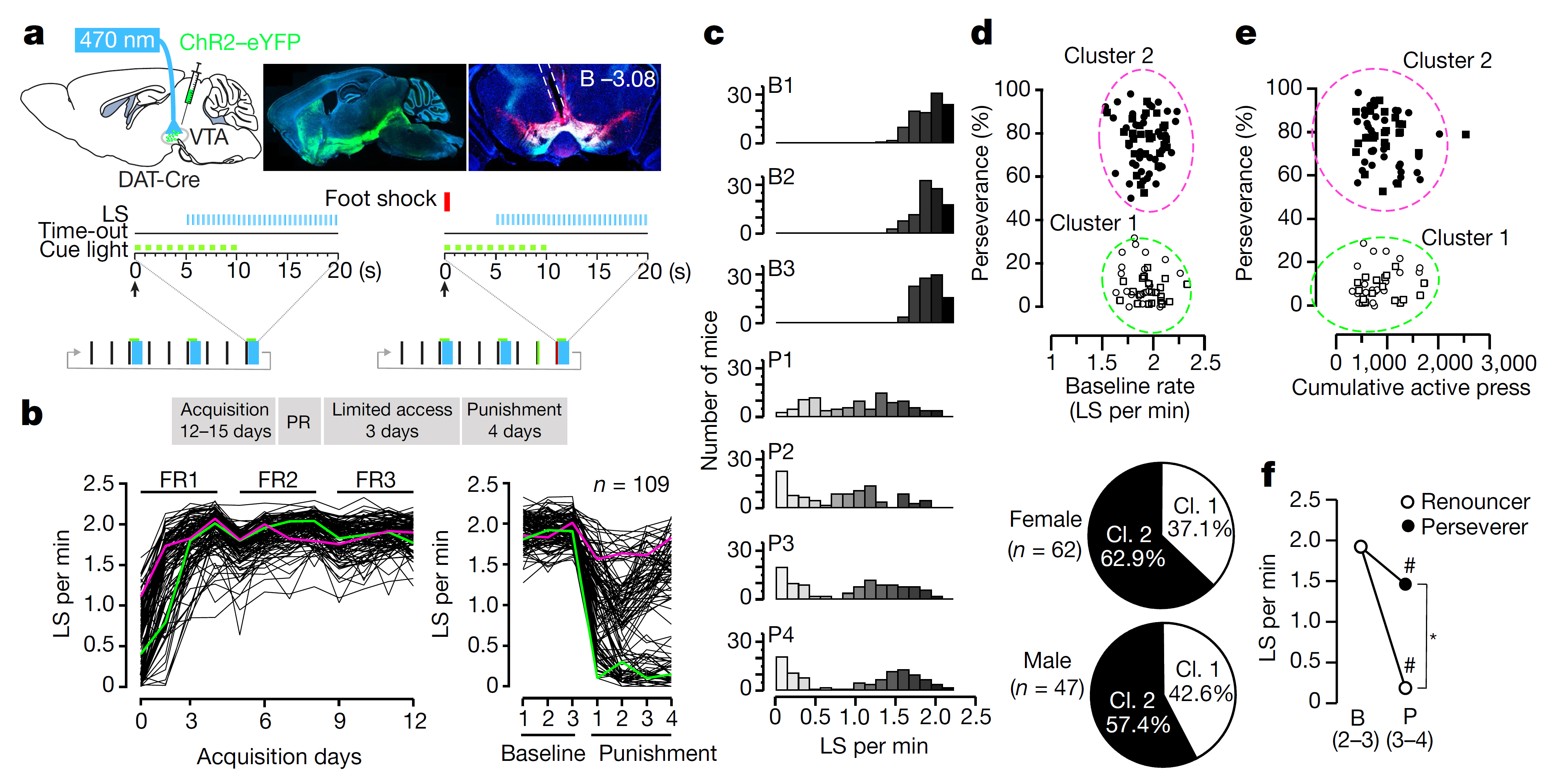
图1 惩戒条件下小鼠成瘾行为的强迫性 (图片来源:Nature)
2.眶额叶皮层到背侧纹状体的投射环路
发现小鼠成瘾行为的强迫性后,作者就其环路水平的神经机制展开研究。已有证据表明眶额叶皮层(OFC)参与成瘾行为的强迫性[3],于是作者通过顺行示踪方法探究其下游脑区投射谱。他们在OFC注射AAV-Chrimson-tdTomato,发现背侧纹状体(DS)的腹中侧亚区具有大量投射纤维,此投射纤维在同一条喙-尾轴上(图2a)。此外,膜片钳电生理结果表明,OFC到DS腹中侧亚区所有神经元的投射均产生兴奋性突触连接,连接率100%,光激活诱发的兴奋性突触后电流也很大,为400-1000pA;而OFC到DS其它亚区神经元投射的连接率与兴奋性突触后电流均大幅降低(图2b)。
接着,作者通过狂犬病毒逆行示踪方法进一步研究OFC-DS环路。他们在D1R-Cre、D2R-Cre、或PV-Cre小鼠的DS中注射AAV-TVA-mCherry和RVG-eGFP,发现D1R-Cre、D2R-Cre小鼠的OFC中具有大量eGFP 神经元,而PV-Cre小鼠的OFC中鲜有eGFP 神经元(图2c)。此结果表明OFC主要投射到DS中表达多巴胺1型受体(D1R)与多巴胺2型受体(D2R)的神经元,而较少投射到表达小清蛋白(PV)的神经元中。
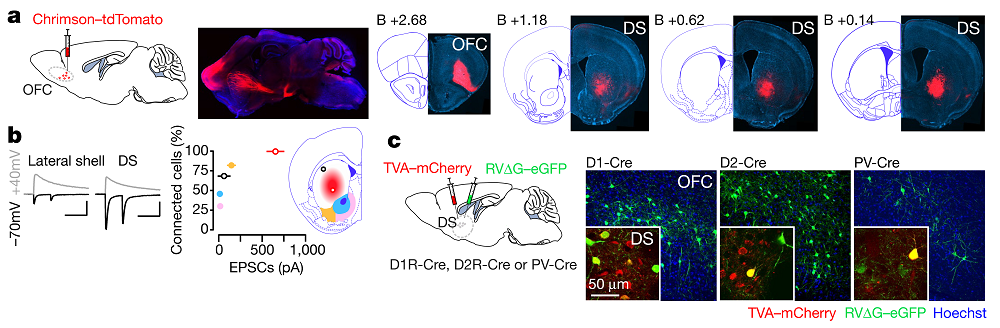
图2 眶额叶皮层投射到背侧纹状体 (图片来源:Nature)
3.OFC-DS环路参与成瘾行为的强迫性
发现OFC重要下游DS后,作者就其功能学方面展开研究。他们在DAT-Cre小鼠的VTA中注射AAV-Chrimson并植入光纤以建立oDASS范式;在OFC中注射AAV-GCaMP6m,DS脑区埋植光纤。他们发现非惩戒条件下,坚持者与放弃者小鼠OFC-DS环路钙信号均逐渐降低;而在惩戒条件下,放弃者小鼠OFC-DS环路钙信号依然逐渐降低,但坚持者小鼠在压杆前OFC-DS环路钙信号显著上升,表明此环路被激活(图3a-d)。
了解OFC-DS环路参与oDASS后,作者就其必要性展开进一步研究。他们在DAT-Cre小鼠的VTA中注射AAV-ChR2并植入光纤来建立oDASS范式,在OFC中注射AAV-eArchT3.0并植入光纤,发现光抑制OFC会大幅减少惩戒条件下oDASS行为,表明成瘾行为的强迫性降低(图3e-h)。但是,这个效应是瞬时的,第二天小鼠便可恢复成瘾行为的强迫性(图3i)。
在下面两个单元中,我们将看到OFC-DS环路突触可塑性对成瘾行为强迫性的长时程影响。
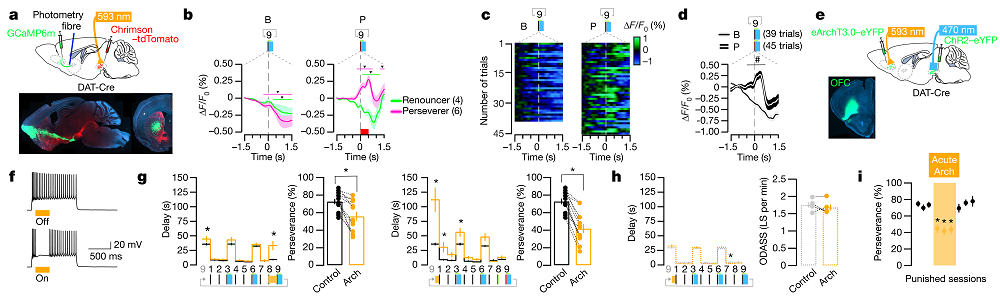
图3 OFC-DS环路参与成瘾行为的强迫性(图片来源:Nature)
4.OFC-DS环路突触可塑性与成瘾行为强迫性的关系
接下来,作者在DAT-Cre小鼠的VTA中注射AAV-ChR2并植入光纤来建立oDASS范式,在OFC中注射AAV-Chrimson。小鼠经过四天的惩戒条件oDASS训练后,作者通过膜片钳电生理技术记录DS中表达D1R或D2R的神经元(忘记D1R、D2R释义的童鞋可寻找图2上方文字)。他们发现放弃者小鼠D1R或D2R的神经元AMPA受体介导的突触后电流与NMDA受体介导的突触后电流的比值(AMPAR/NMDAR ratio, A/N)显著低于坚持者小鼠D1R或D2R的神经元的A/N,且小鼠成瘾行为的强迫性与A/N成正比(在电生理学中,A/N可视为突触可塑性的表征)(图4a-e)。若小鼠只接受电刺激而未经过oDASS训练,其DS中D1R或D2R的神经元的A/N不变(图4f)。
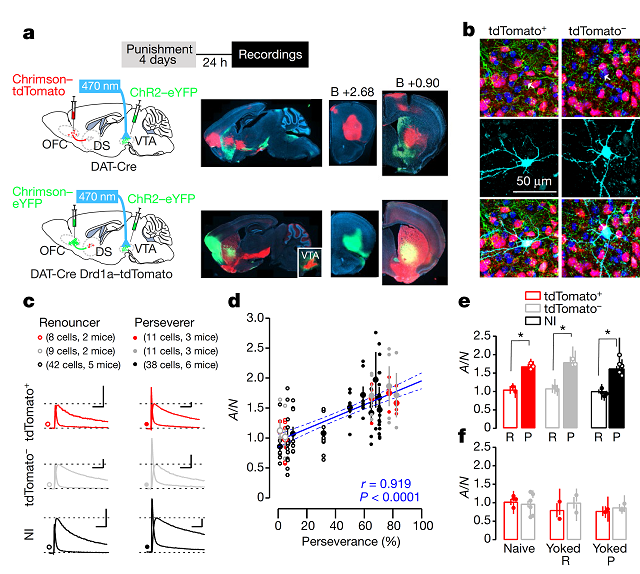
图4 OFC-DS环路突触可塑性与成瘾行为强迫性的关系( 图片来源:Nature)
5.成瘾行为强迫性的双向调控
上文中,我们了解到OFC-DS环路突触可塑性与成瘾行为强迫性呈正相关。那么,改变OFC-DS环路的突触可塑性是否可双向调控成瘾行为的强迫性?作者就此展开最后的研究。
他们发现20Hz光激活OFC-DS环路可诱导放弃者小鼠与未训练小鼠产生长时程增强效应(LTP),而不能诱导坚持者小鼠产生LTP(图5a),因为坚持者小鼠OFC-DS环路的突触强度已经足够高(图4c-d)。行为学方面,20Hz光激活OFC-DS环路可显著增加成瘾行为的强迫性,且此效应具有持续性(图5b-d)。
接着,他们发现1Hz光激活OFC-DS环路可诱导放弃者小鼠与未训练小鼠产生长时程抑制效应(LTD),而坚持者小鼠的结果不稳定(图5e),很可能由多巴胺对D1R的作用所致[7],作者通过D1R拮抗剂SCH23390验证此假设(图5f)。行为学方面,1Hz光激活OFC-DS环路可显著减少成瘾行为的强迫性,此效应同样具有持续性(图5g-h)。
综上,通过不同频率光激活OFC-DS环路可改变其突触可塑性,进而双向调控成瘾行为的强迫性。
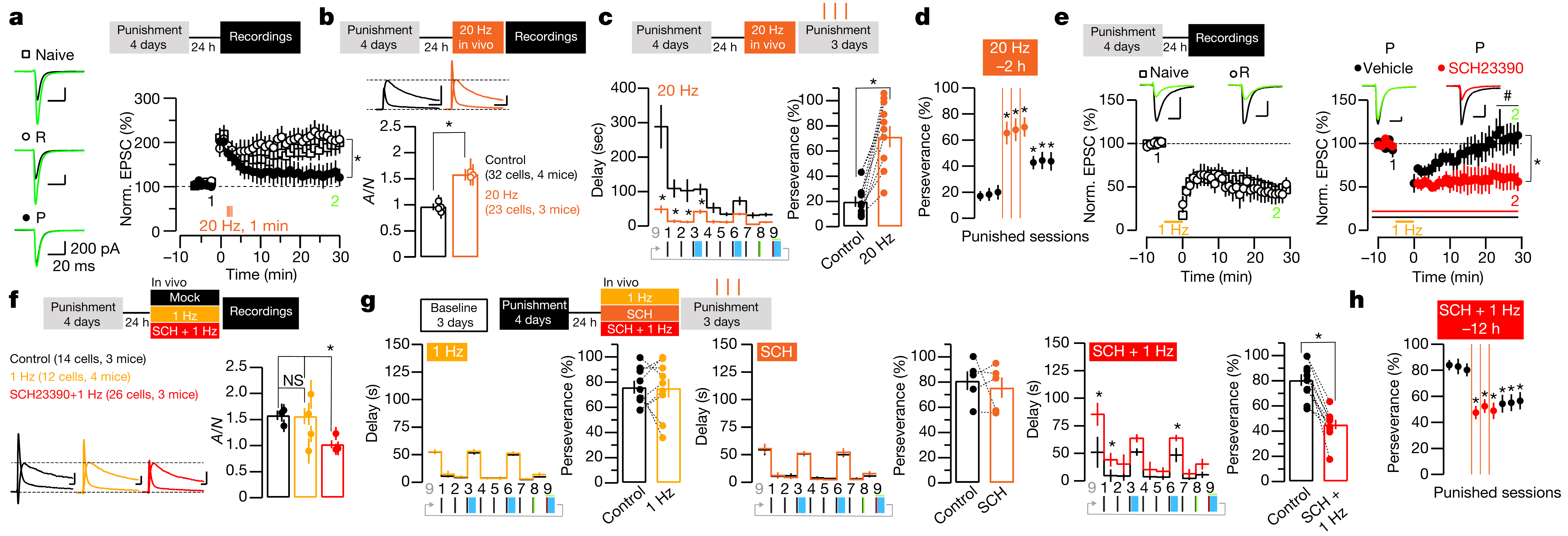
图5 OFC-DS环路突触可塑性双向调控成瘾行为的强迫性( 图片来源:Nature)
总结香烟、手机、游戏等各种成瘾行为在日常生活中随处可见,此行为具有不畏困难的强迫性。然而,对于调控此强迫性的神经环路机制,我们知之甚少。本篇文章结合神经示踪、光遗传学、膜片钳电生理、行为学等多种方法筛选出坚持者小鼠与放弃者小鼠,并发现OFC-DS环路参与成瘾行为的强迫性。此外,通过不同频率刺激OFC-DS环路诱发LTP或LTD可双向长期调控成瘾行为的强迫性。这项研究揭示了成瘾行为的强迫性的神经环路基础,为临床戒断各种成瘾物质提供强有力的支持,我们也终将摆脱困扰,熄灭香烟,放下手机,停止游戏!
参考文献
1.Di Chiara, G., et al., Dopamine and drug addiction: the nucleus accumbens shell connection. Neuropharmacology, 2004. 47 Suppl 1: p. 227-41.
2.Luscher, C. and M.A. Ungless, The mechanistic classification of addictive drugs. PLoS Med, 2006. 3(11): p. e437.
3.Pascoli, V., et al., Sufficiency of Mesolimbic Dopamine Neuron Stimulation for the Progression to Addiction. Neuron, 2015. 88(5): p. 1054-1066.
4.Jonkman, S., Y. Pelloux, and B.J. Everitt, Differential roles of the dorsolateral and midlateral striatum in punished cocaine seeking. J Neurosci, 2012. 32(13): p. 4645-50.
5.Pascoli, V., et al., Stochastic synaptic plasticity underlying compulsion in a model of addiction. Nature, 2018. 564(7736): p. 366-371.
6.Brown, M.T., C. Korn, and C. Luscher, Mimicking synaptic effects of addictive drugs with selective dopamine neuron stimulation. Channels (Austin), 2011. 5(6): p. 461-3.
7.Shen, W., et al., Dichotomous dopaminergic control of striatal synaptic plasticity. Science, 2008. 321(5890): p. 848-51.

扫一扫,反馈当前页面
和元生物